De la microbiologie pour ceux qui ont les crocs
L’inefficacité n’existe pas.
L’azote est un constituant principal de toute vie, étant essentiel pour par exemple protéines et ADN. Malgré son abondance sur terre, l’approvisionnement en azote est un facteur limitant la croissance pour la plupart des formes de vie. Je ne parle pas des amateurs de fitness qui boivent des shakes protéinés pour la masse musculaire, mais – bien sûr – des micro-organismes. Les bactéries et les archées sont les seules formes de vie capables de fixer l’azote de l’air et dans les cellules. Cela signifie que tout l’azote dans notre corps (mais aussi dans celui d’autres animaux ou plantes) a été «préparé» pour nous par des bactéries et des archées. Les seules enzymes connues pour catalyser un tel processus sont appelées nitrogénases.
Trois variantes de ces nitrogénases existent, du nom de différents métaux trouvés dans leur site actif : le molybdène (Mo), le vanadium (V) et le fer (Fe). Les enzymes prélèvent l’azote de l’atmosphère et une source d’électrons pour réduire le N2 en NH3, mais produisent également une gamme de sous-produits (principalement H2). Des trois variantes, la Mo-nitrogénase est l’enzyme la plus ancienne et les deux autres ont évolué à partir de celle-ci (1). Cependant, la Mo-nitrogénase est également considérée comme l’enzyme de fixation de l’azote la plus efficace car elle produit le moins de sous-produits (1). Donc, si les nitrogénases V et Fe sont moins efficaces dans leur travail, pourquoi auraient-elles évolué ?
Katja Luxem et ses collègues de l’Université de Princeton, NJ, ont entrepris de trouver des réponses à l’aide de Rhodopseudomonas palustris (2). Cette bactérie contient les gènes des trois enzymes, mais – comme le montre l’article – dépend généralement de la Mo-nitrogénase pour son approvisionnement en azote. De plus, les chercheurs ont testé trois mutants génétiques de R. palustris qui ne contenaient chacun qu’une seule des isozymes de la nitrogénase. Ils ont découvert que, selon la source de carbone, la Mo-nitrogénase ne fixait pas l’azote le plus rapidement. La V-nitrogénase a soutenu une croissance plus rapide sur d’autres substrats, et sur l’acétate a même surpassé le type sauvage (Figure 1).

Lorsqu’il est nourri avec de l’acétate, le mutant n’exprimant que la V-nitrogénase a produit à peu près autant de sous-produit (H2) que le type sauvage. Les auteurs soupçonnent que cela a à voir avec la température : l’idée que la Mo-nitrogénase est la plus efficace est née d’expériences à 30 °C, mais cette expérience a été réalisée à 19 °C – et ils ne sont pas les premiers à voir l’efficacité de la baisse de la Mo nitrogénase à des températures plus basses (3). L’existence de la V-nitrogénase à côté de la Mo-nitrogénase pourrait donc être liée à la température de l’environnement dans lequel vit la bactérie.
Luxem et ses collègues montrent également que l’efficacité de la fixation de l’azote ne dépend pas uniquement des nitrogénases, mais de toute une cascade d’enzymes et de cofacteurs délivrant les électrons et l’énergie pour la catalyse. En utilisant la protéomique, ils ont découvert que le mutant de la V-nitrogénase, qui s’est si bien comporté sur l’acétate, avait un système de protéines de distribution d’énergie très similaire au type sauvage. Le mutant portant uniquement la Mo-nitrogénase avait un profil différent d’enzymes de soutien. L’évolution des différentes formes de nitrogénase pourrait donc aussi être liée à l’interaction avec d’autres protéines.

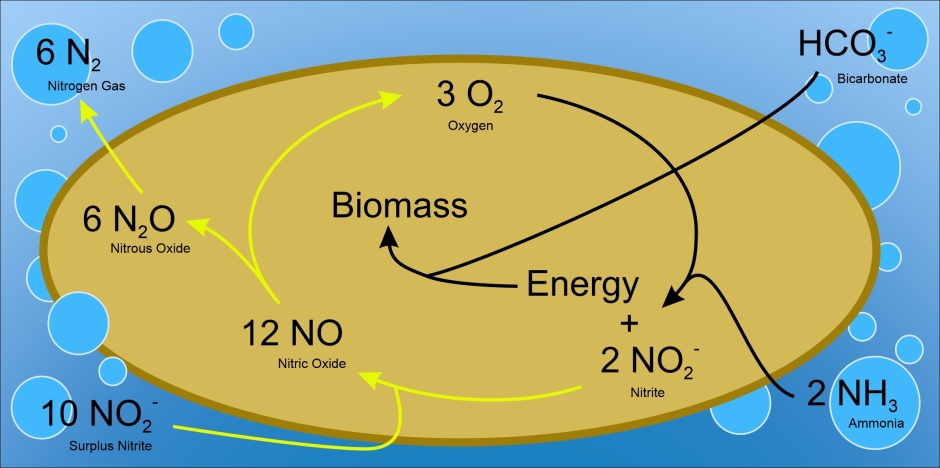
Il est intéressant de noter que R. palustris ne compense pas les nitrogénases plus lentes en dépensant plus de ressources pour la fixation de l’azote. Outre l’azote, R. palustris peut également fixer le carbone à partir du CO2 (dans un processus similaire à la photosynthèse). Pour fixer l’un ou l’autre élément, des électrons sont nécessaires. La bactérie doit donc équilibrer la quantité de chacun qu’elle fixe (voir figure 2, flèches E et F). Dans les expériences de Luxem, l’apport d’azote limite la croissance de R. palustris (et reçoit toute la source de carbone dont il pourrait avoir besoin). Il semblerait donc utile de rediriger le plus d’électrons possible vers la fixation d’azote. Cependant, les auteurs rapportent quelque chose de différent : le pourcentage d’électrons disponibles utilisés pour la réduction reste constant, autour de 60 %, pour différentes sources de carbone et enzymes de nitrogénase. Ceci est particulièrement surprenant pour la Fe-nitrogénase, qui fixe très peu de N2 au détriment de produire beaucoup de H2. Les auteurs proposent qu’une certaine pression de sélection évolutive (encore inconnue) existe contre l’abolition de la fixation du carbone.
En somme, il semble que la V-nitrogénase « inutile » n’ait tout simplement jamais été examinée d’une manière qui montrait sa force : la fixation de l’azote à des températures plus basses. Grâce à Luxem et son équipe, nous avons eu un aperçu de son utilité. Et en temps voulu, nous apprécierons sans aucun doute l’avantage de la Fe-nitrogénase !
Image de couverture: https://commons.wikimedia.org/wiki/File:Nitrogen_Cycle_1.svg
Traduit par: Anaïs Biclot