De la microbiologie pour ceux qui ont les crocs
Quatre antibiotiques et le microbiote intestinal
Le microbiote intestinal, constitue la plus grande population de micro-organismes résidant dans l’intestin du corps humain. Les divers microbes présents dans notre intestin influencent nos caractéristiques immunitaires, métaboliques et neurocomportementales.
Les microbes présents dans l’intestin peuvent être brièvement regroupés (trois types) en fonction de leur interaction avec le système hôte : symbiotes/ mutualistes, commensaux et pathogènes. Dans le premier cas, les mutualistes et l’hôte sont très intimement associés et en bénéficient également. Les commensaux, pour leur part, interagissent de manière lâche avec l’hôte pour obtenir des avantages tels que la nutrition et la protection, et en retour, ils fournissent généreusement à l’hôte des nutriments essentiels, contribuent à l’architecture intestinale tout en se défendant contre la colonisation d’agents pathogènes opportunistes. Les agents pathogènes exploitent l’environnement intestinal soit par des stratégies “évoluées” permettant leur réplication, soit en exploitant les nutriments disponibles et les signaux de régulation pour leur propre expansion égoïste et leur virulence.
Les mutualistes et les commensaux sont ceux qui stabilisent le plus les microbiomes intestinaux, tout en fournissant à l’hôte des enzymes bénéfiques et d’autres molécules supplémentaires que l’hôte utilise avec reconnaissance mais ne produit pas. Souvent, lorsqu’ils sont présents en petites quantités dans l’intestin, certains microbes sont très bénéfiques et peuvent même réduire l’inflammation intestinale (Parabacteroides, Faecalibacterium, Coprococcus et Odoribacter), mais deviennent virulents à des concentrations plus élevées.
Bien que les antibiotiques constituent une avancée dans l’atténuation des infections bactériennes, leur consommation excessive a un impact négatif sur le microbiote intestinal : ils éliminent de manière invasive les bactéries inhérentes – souvent la plupart des bactéries bénéfiques, qui sont alors simultanément remplacées par les microbes pathogènes opportunistes présents dans l’intestin. L’utilisation à long terme d’antibiotiques peut également entraîner une résistance aux antibiotiques chez les bactéries intestinales, en plus de les inhiber, et peut également déclencher des maladies intestinales.
Jusqu’à présent, l’impact des antibiotiques sur le microbiote intestinal est connu grâce à notre compréhension des familles de bactéries et/ou des espèces pathogènes spécifiques présentes, mais nous n’avons pas encore véritablement exploré l’effet des antibiotiques sur les bactéries, qu’elles soient bénéfiques ou pathogènes, notamment en cas de dysbiose du microbiote intestinal. Les implications de cette condition sont importantes pour nous, car lors d’une dysbiose, la réduction de la diversité du microbiote peut augmenter les risques d’inflammation, accroître la sensibilité aux agents pathogènes et produire des génotoxines ainsi que des métabolites cancérigènes.
Dans une étude menée par Ce Huang et al (2022), la technologie de séquençage du gène de l’ARNr 16S a été employée pour analyser les effets à court et à long terme de quatre antibiotiques : ampicilline, vancomycine, métronidazole et néomycine sur le microbiote intestinal des rongeurs. Ils souhaitaient étudier l’impact des méthodes actuelles d’élimination des microbes intestinaux tout en fournissant des informations cliniquement pertinentes sur les antibiotiques destinés à traiter les infections bactériennes.
Image source: https://geneticeducation.co.in/16s-rrna-gene-sequencing-and-importance
Ils ont constaté que les antibiotiques ampicilline, vancomycine et métronidazole réduisaient l’abondance de Coprococcus et Lactobacillus, deux bactéries Gram positives proéminentes avec les souches probiotiques. Ils ont également constaté que l’ampicilline et la vancomycine, qui auraient théoriquement dû tuer Enterococcus – un anaérobie facultatif Gram positif avec de multiples souches pathogènes – ont au contraire augmenté son abondance, tandis que le métronidazole n’a eu aucune influence. Ils en ont déduit que ces observations étaient liées à l’influence du mécanisme de l’antibiotique et à la compétition ultérieure entre les diverses communautés bactériennes induite par la dysbiose.
Après avoir retiré le ou les antibiotiques des rongeurs pendant un mois, ils ont examiné la capacité du microbiote intestinal murin à se rétablir. Ils ont constaté que l’impact des antibiotiques était continu et que la structure du microbiote changeait de façon dynamique. En outre, même lorsque le microbiote intestinal s’était (étonnamment) rétabli quelques semaines après l’arrêt du traitement antibiotique, la dynamique du microbiote était toujours différente de ce qu’elle était avant le traitement antibiotique.
L’une des observations a porté sur les modifications de la structure du microbiote avant et après le traitement antibiotique, qui étaient dans certains cas permanentes. Cela montre que l’exposition aux antibiotiques peut non seulement avoir des effets à court terme, mais aussi des effets à long terme.
Leur équipe affirme qu’en cas d’exposition à un antibiotique, les bactéries ont tendance à devenir résistantes plus fréquemment, ce qui peut être observé même dans le microbiome intestinal. Ils ajoutent que la sensibilité de divers micro-organismes à différents antibiotiques varie et que la communauté (par exemple, le microbiome intestinal) se stabilise à un nouvel état une fois que les espèces sensibles diminuent radicalement ou sont anéanties.
Par conséquent, l’émergence d’une abondance de bactéries pathogènes dans l’intestin en raison du déclin des espèces probiotiques, suivie de leur éventuelle résistance aux antibiotiques, est réellement préoccupante et constitue une recette pour les maladies et les infections de l’hôte. L’équipe a déduit que Bacteroides (probiotique potentiel de prochaine génération) et Escherichia, inhérentes à l’intestin, sont deux candidates les plus susceptibles de développer des souches résistantes aux antibiotiques.
Les chercheurs ont conclu que les quatre antibiotiques, individuellement ou en combinaison, réduisaient la diversité microbienne. Ils reconnaissent que leurs résultats (au niveau du genre) concordent avec des études antérieures selon lesquelles les post-antibiotiques diminuent les bactéries potentiellement bénéfiques en raison d’une diminution globale de la diversité du microbiote.
Ils mettent également en garde contre une limite majeure de leurs travaux : la technologie de séquençage du gène de l’ARNr 16S utilisée ne permet pas de différencier au niveau des espèces de manière “fiable” lors de l’attribution taxonomique des différentes bactéries observées. Il s’agit d’un inconvénient car, en général, les probiotiques et pathobiontes potentiels dépendent de l’espèce plutôt que du genre.
Étant donné que les antibiotiques ont été administrés par voie orale sur une courte période (2 semaines) et que des observations radicales ont été faites par la suite, ce travail ouvre la voie à de nouvelles recherches. Par exemple, différents dosages d’antibiotiques et différentes voies d’administration pourraient être explorés plus avant. Les différents mécanismes à l’origine des changements observés dans le microbiote pourraient également être étudiés.
Ainsi, ces scientifiques sont fortement en faveur d’une prescription réfléchie des antibiotiques en clinique. La transplantation fécale et l’administration de probiotiques sont deux moyens de restaurer le microbiote intestinal, recommandent-ils.
Article original: Ce Huang, Shengyu Feng, Fengjiao Huo, Hailiang Liu , Effects of Four Antibiotics on the Diversity of the Intestinal Microbiota, Microbiology Spectrum, March/April 2022 Volume 10 Issue 2 e01904-21
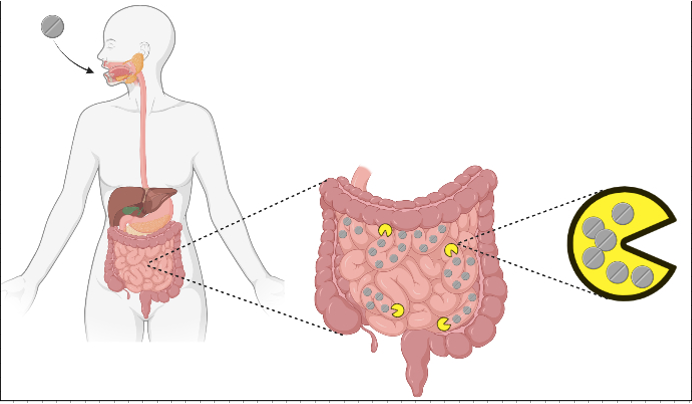
Featured image: Original image using Biorender.com
Traduit par Anaïs Biclot