De la microbiologie pour ceux qui ont les crocs
Microbes & cellules immunitaires luttent contre la résistance aux antibiotiques.
Les antibiotiques sont des substances chimiques capables de provoquer la destruction ou d’empêcher la croissance des micro-organismes [1]. La découverte de la pénicilline en 1928 par Alexander Fleming a marqué l’âge d’or des antibiotiques, et les humains pensaient avoir trouvé l’arme miracle dans la lutte contre les maladies infectieuses [2]. Mais à mesure que sa popularité augmentait, le risque de développer une résistance de la part de l’agent pathogène augmentait également. Au fil du temps, ces agents pathogènes ont développé différents mécanismes de défense pour se protéger contre presque tous les antibiotiques disponibles qui menaçaient leur survie [1]. En réponse à cette situation, les organisations internationales de santé et les chercheurs du monde entier unissent désormais leurs forces pour s’attaquer à la crise de la résistance aux antibiotiques.
Où trouve-t-on ces agents pathogènes et que provoquent-ils ?
Les agents pathogènes se trouvent à différents endroits du corps ou de l’environnement, d’où ils peuvent facilement accéder à leurs hôtes. Il s’agit notamment de la peau, des poumons, de l’intestin ou du sang. Ils sont impliqués dans le développement de maladies telles que les infections des voies urinaires, les pneumonies ou les septicémies [3].
Klebsiella pneumoniae est l’un des agents pathogènes que l’on trouve couramment dans l’intestin où il peut provoquer des infections potentiellement mortelles. Sa forme résistante aux antibiotiques s’est maintenant répandue dans toutes les régions du monde et même les antibiotiques les plus puissants peuvent ne plus être efficaces [4].
Alors pourquoi ne pas simplement empêcher Klebsiella pneumoniae d’infecter et de se propager en premier lieu ?
Pour ce faire, nous devrions connaître les facteurs qui contribuent au succès de l’infection et de la colonisation. Cela nous amène à nous interroger sur la relation entre le microbiome, l’immunité de l’hôte et le résultat infectieux.
Récemment, Sequeira et ses collègues ont découvert deux nouveaux mécanismes qui décrivent comment les membres du microbiote de l’hôte peuvent activer son immunité de manière à empêcher l’infection par K. pneumoniae[5]. Voyons de plus près comment cela est possible…
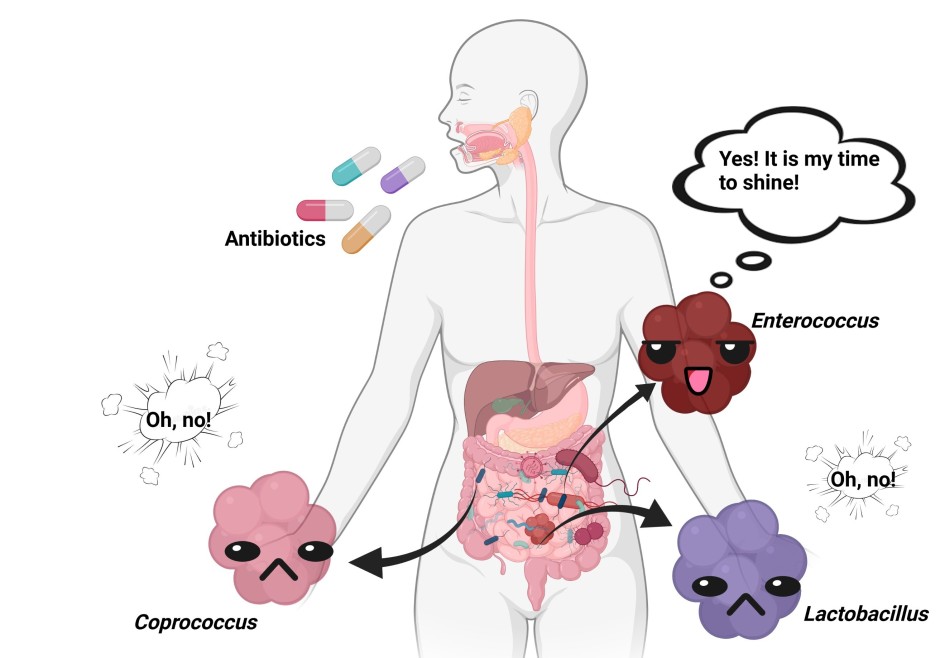
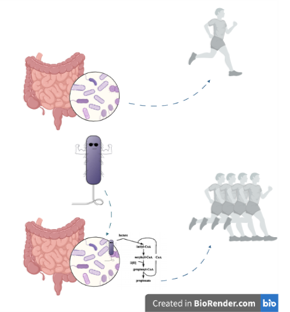
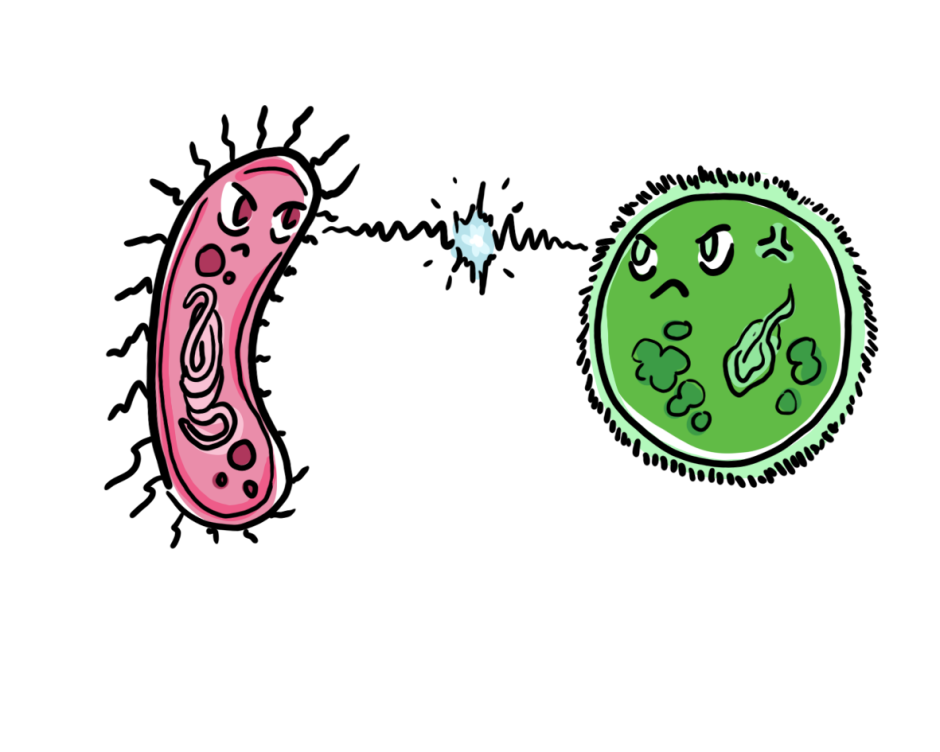
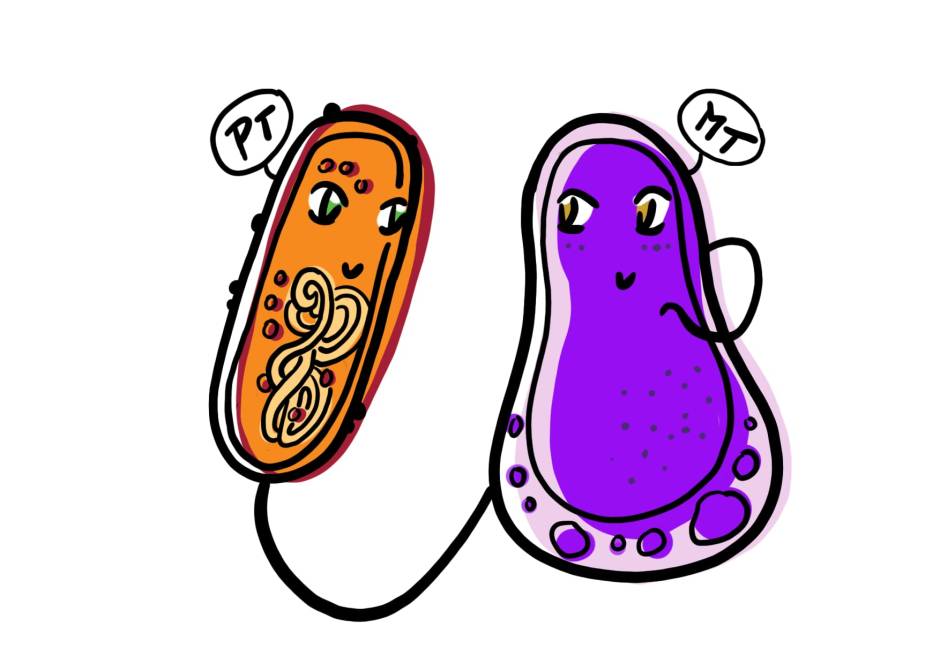
Le microbiote humain se compose de différents micro-organismes en fonction du site corporel. Les espèces de Bacteroidetes par exemple (sous leur forme amicale) se trouvent dans l’intestin et leur génome peut abriter un locus de facteur de colonisation commensale (CCF). En présence d’un CCF, les espèces de Bacteroidetes produisent une capsule de polysaccharide protectrice. Par conséquent, une forte association avec la muqueuse intestinale est établie, ce qui entraîne une régulation positive du système immunitaire inné [5]. Cela inclut l’initiation de la réponse des macrophages avec une sécrétion accrue d’IL-36𝛄. L’IL-36 est une cytokine pro-inflammatoire (une molécule de signalisation) qui, en se liant à son récepteur, active une cascade de signalisation qui empêche K. pneumoniae de coloniser l’intestin (Figure 1, à gauche). La signalisation de l’IL-36 dépend des macrophages. La diminution de quantité de ces cellules, ainsi que du locus CCF, entraîne donc une sensibilité à K. pneumoniae [6].

Si l’on considère les voies aériennes supérieures, ce ne sont pas les Bacteroidetes mais les Proteobacteria qui semblent déterminer la protection ou non contre K. pneumoniae [5]. Elles le font par le biais de la signalisation de la cytokine IL-17A en restaurant la production homéostatique d’IL-17A dans les voies aériennes supérieures. Par conséquent, la colonisation de K. pneumoniae non encapsulée peut être empêchée en présence de protéobactéries [6]. Cependant, la protection a échoué quand K. pneumoniae est encapsulé car la bactérie a réussi à coloniser les voies aériennes supérieures (Figure 1, droite). Alors que les Bacteroidetes utilisent l’encapsulation pour se protéger contre la colonisation de K. pneumoniae dans l’intestin, K. pneumoniae utilise l’encapsulation pour résister à la protection des Proteobacteria dans les voies aériennes supérieures. Si l’on administre de l’anti-IL-17A pour perturber la signalisation des cytokines, la suppression de l’agent pathogène est obtenue pour K. pneumoniae non encapsulée mais non quand K. pneumoniae encapsulée [6]. Cela indique que l’agent pathogène développe lui-même un mécanisme de défense contre la résistance à la colonisation.
En résumé, les auteurs ont montré que le microbiote adulte peut protéger contre la colonisation par K. pneumoniae résistant aux antibiotiques dans l’intestin mais pas dans les voies aériennes supérieures. Cela indique que différentes stratégies de virulence du même pathogène pour surmonter la réponse immunitaire de l’hôte sont présentes dans différents sites anatomiques. La compréhension des modes de communication entre les agents pathogènes et le microenvironnement tissulaire pourrait permettre de développer de nouvelles stratégies antimicrobiennes comme alternative aux antibiotiques sur-utilisés. En étendant les études à d’autres agents pathogènes cliniquement pertinents, par exemple ceux associés à des infections multirésistantes, les mécanismes communs de résistance à la colonisation pourraient être étudiés afin d’identifier des modèles entre l’interaction des agents pathogènes, du microbiome et du système immunitaire de l’hôte.
Lien vers l’article original : Sequeira, R. P., et al. (2020). “Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling.” Nat Microbiol 5(2): 304-313.
Autres références:
- Aminov, R. I. (2009). “The role of antibiotics and antibiotic resistance in nature.” Environ Microbiol 11(12): 2970-2988.
- Hutchings, M. I., et al. (2019). “Antibiotics: past, present and future.” Curr Opin Microbiol 51: 72-80.
- CDC – Healthcare-associated Infections – Homepage. https://www.cdc.gov/hai/index.html September 12, 2021
- WHO – Antimicrobial Resistance – Homepage. https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance September 12, 2021
- Solis, A. G. and M. Levy (2020). “The biogeography of colonization resistance.” Nat Microbiol 5(2): 234-235.
- Sequeira, R. P., et al. (2020). “Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling.” Nat Microbiol 5(2): 304-313.
Image credit: Darryl Leja, NHGRI on Flickr
Ecrit par Thi Anh Mai Pham
Traduit par Clémence Joseph