De la microbiologie pour ceux qui ont les crocs
Une approche double à la résistance aux antibiotiques.
Les antibiotiques sont un type de médicament que nous avons tous utilisé à un moment ou à un autre de notre vie. Depuis qu’Alexander Fleming a découvert le premier antibiotique, la pénicilline, en 1928, et ouvert la voie à l’ère des découvertes d’antibiotiques qui a suivi, ces composés ont révolutionné le domaine de la médecine. Alors que les maladies infectieuses et les fléaux étaient en tête des taux de mortalité dans le passé, avec l’aide des antibiotiques, ce sont maintenant les maladies non transmissibles telles que les maladies cardiovasculaires qui occupent cette place. Mais cela ne signifie pas que nous n’aurons plus jamais à nous soucier des conséquences de l’ère pré-antibiotique.
Alors que la communauté scientifique et médicale a progressé dans l’identification des moyens de combattre les agents pathogènes bactériens, ces derniers ont également acquis différentes stratégies pour échapper aux effets négatifs des antibiotiques et développer une résistance appelée antibiorésistance. Cette résistance est le résultat d’une résistance naturelle que certaines espèces bactériennes peuvent avoir et de mutations génétiques qui sont propagées à la descendance en raison, entre autres, de l’avantage sélectif de survie.
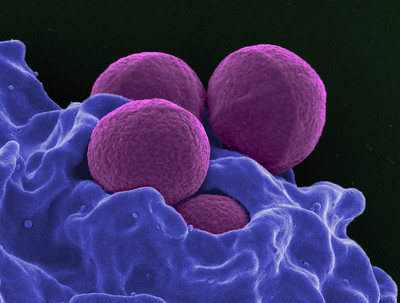
Le staphylocoque doré (Staphylococcus aureus) est une bactérie pathogène généralement inoffensive que l’on trouve sur la peau, le nez et d’autres parties du corps, mais il est capable de causer des dommages dans certaines circonstances. En fait, il s’agit de la principale cause d’infections de la peau et des tissus mous, et il peut également provoquer des pneumonies mortelles, des infections du sang et du cœur.
S. aureus devient de plus en plus résistant à la méthicilline, l’antibiotique utilisé comme première ligne de défense contre cet agent pathogène. Cela oblige les médecins à se tourner vers des antibiotiques de dernier recours, après quoi il n’y a plus d’autres traitements pour les bactéries résistantes. En plus de développer une résistance aux antibiotiques, le Staphylococcus aureus résistant à la méthicilline (SARM) possède également des mécanismes qui lui permettent de se cacher des cellules de première intervention de notre système immunitaire, comme les neutrophiles, qui ne parviennent pas à nous protéger correctement contre cet agent pathogène. Ces deux propriétés du SARM rendent le traitement de ces infections extrêmement difficile et entraînent donc des conséquences souvent fatales. Cela souligne l’urgence médicale de développer de nouvelles thérapies ou stratégies thérapeutiques pour lutter contre les bactéries multirésistantes.
Une nouvelle approche actuellement explorée pour résoudre ce problème est le développement et l’utilisation d’immunothérapies qui s’inspirent des stratégies antibactériennes de notre corps et renforcent notre réponse immunitaire. Par exemple, notre système immunitaire produit des peptides de défense de l’hôte (HDP) qui peuvent à la fois tuer/inactiver directement les agents pathogènes et créer un gradient chimique autour d’eux afin de recruter d’autres cellules immunitaires pour combattre l’infection. Cette stratégie pourrait donc être une solution pour le SARM, qui se cache du système immunitaire et résiste à de nombreux antibiotiques actuellement disponibles.
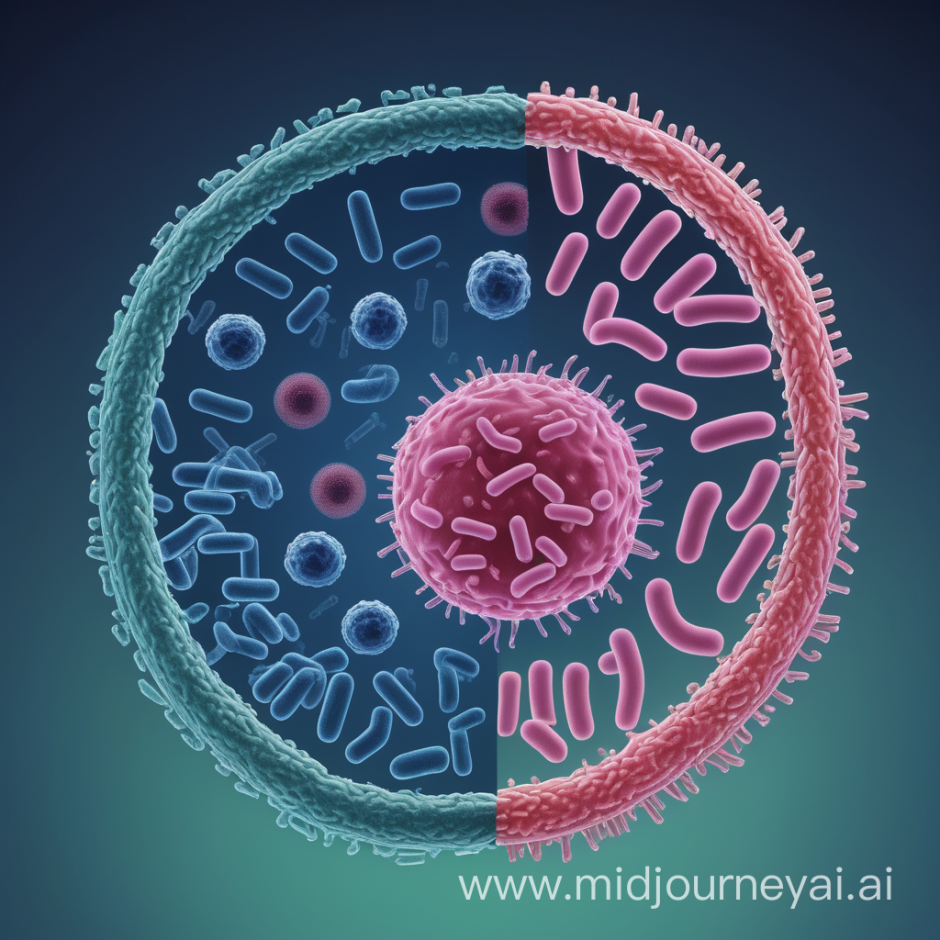
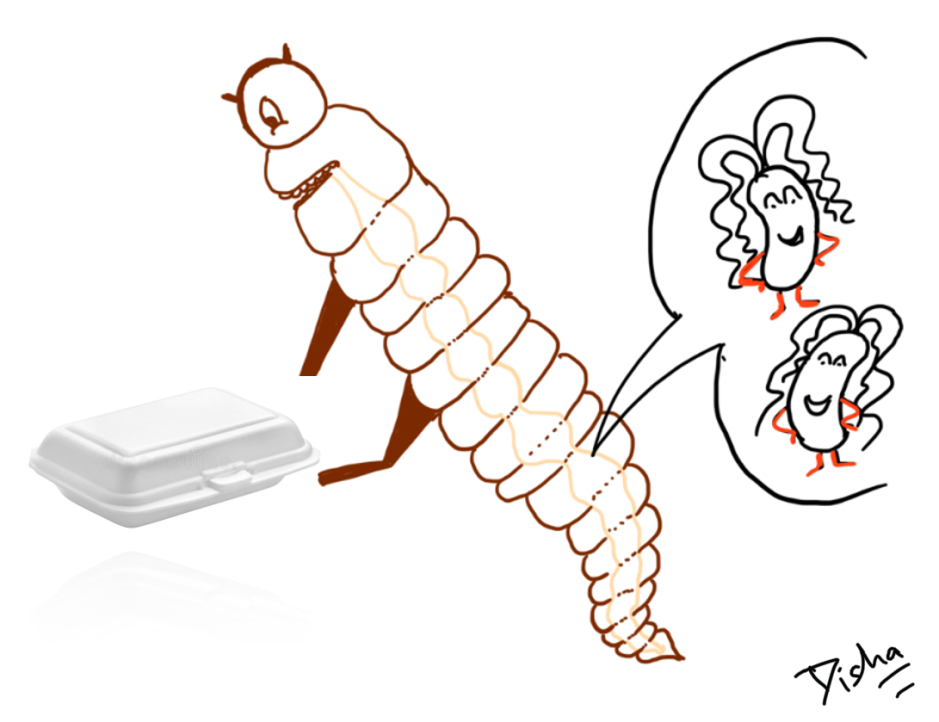
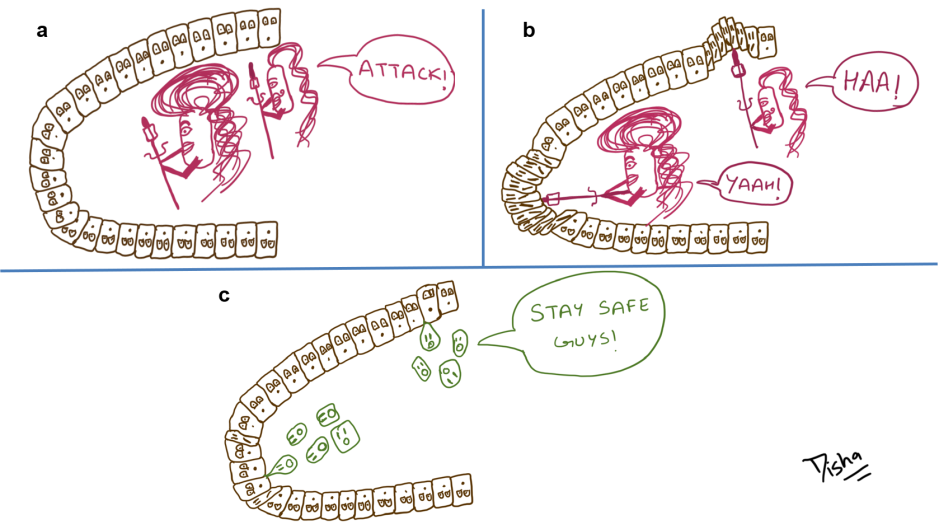
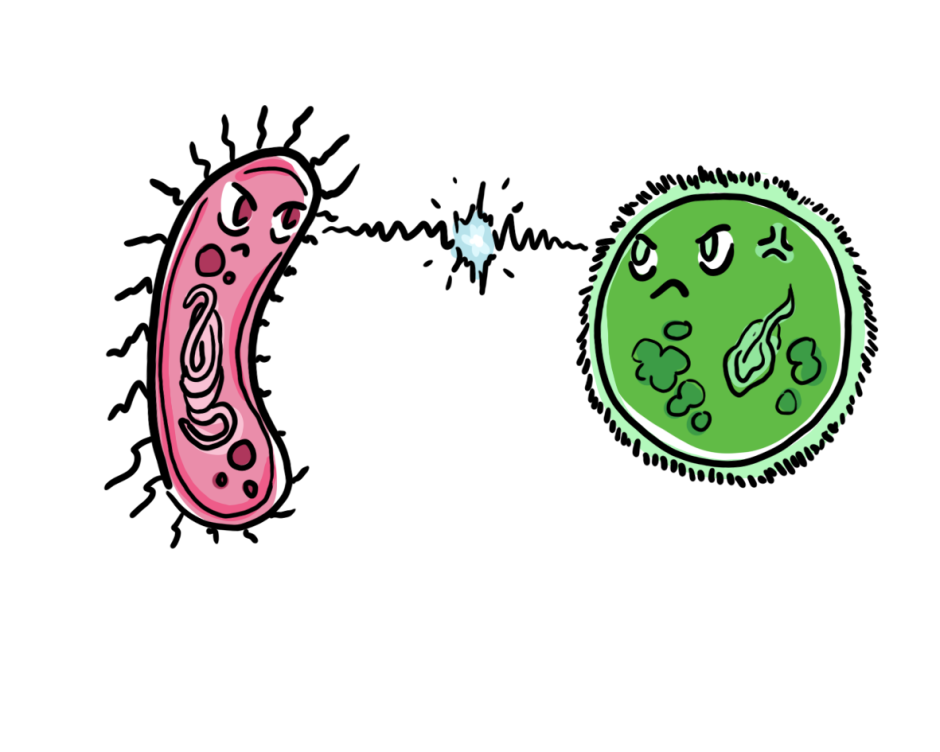
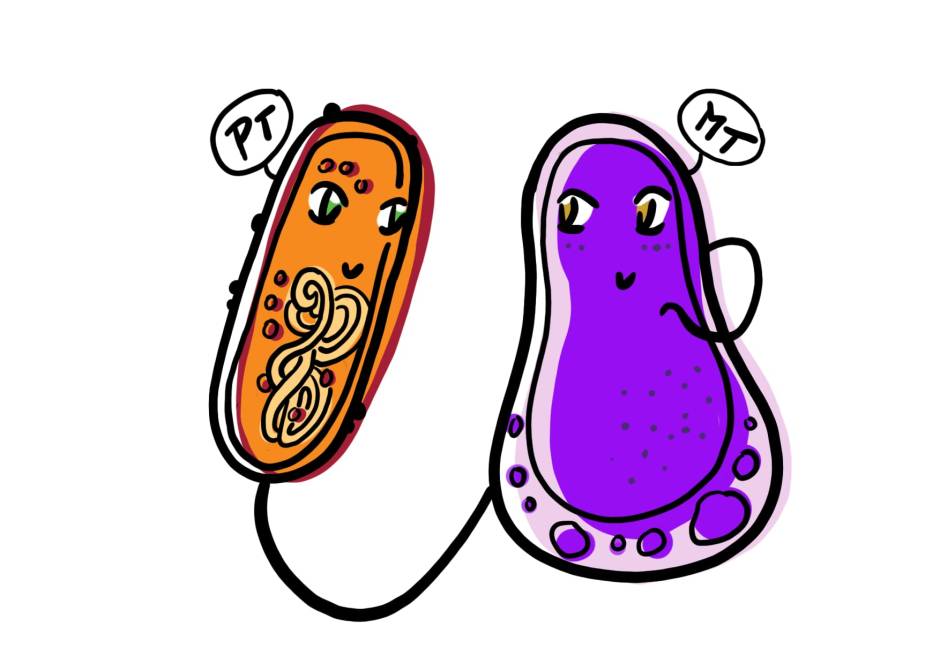
Intrigués par ces molécules naturelles, Payne et al. (2021) ont proposé la création d’une version artificielle des HDP pour traiter le SARM. Pour ce faire, ils ont suggéré de lier/combiner chimiquement un composé activant le système immunitaire (qui peut créer un gradient chimique pour attirer les cellules immunitaires vers le site de l’infection par le SARM) à un composé ciblant les bactéries (qui se liera spécifiquement au SARM et le tuera). Cette combinaison de composés permettrait au système immunitaire de détecter et d’attaquer spécifiquement la bactérie MRSA envahissante (figure 2a).
Pour l’activation immunitaire, ils ont choisi des peptides formylés (fPeps) qui sont de petites molécules bien connues pour se lier aux neutrophiles et les activer, favorisant ainsi leur recrutement au site de l’infection et la phagocytose (ingestion, digestion à l’aide de mécanismes antibactériens, suivie de la mort des neutrophiles) des bactéries. Ils possèdent cette incroyable capacité car, dans la nature, les fPeps sont un composant omniprésent des protéines bactériennes et notre système immunitaire a donc appris à les reconnaître et à déclencher une réponse immunitaire en leur présence. Pour leur composé ciblant les bactéries, ils ont choisi l’antibiotique vancomycine qui est bien connu pour se lier à la paroi cellulaire de S. aureus et la détruire.
La combinaison artificielle des deux composés crée alors un incroyable immunothérapeutique qui se lie directement aux cellules de S. aureus, tout en créant un gradient chimio-attractif autour du site d’infection pour favoriser le recrutement des neutrophiles et la destruction du SARM (figure 2b). Jusqu’à présent, Payne et al. (2021) ont démontré le succès impressionnant de cet immunothérapeutique dans des modèles d’infection à SARM en éprouvette/boîte de Pétri (à l’extérieur d’un organisme) et chez des souris atteintes de pneumonie à SARM.
S’il s’agit d’une nouvelle passionnante, il convient de noter qu’il reste encore un long chemin de recherche à parcourir avant de déterminer si cette stratégie peut être utilisée cliniquement chez l’homme. Cependant, ces travaux de recherche constituent une nouvelle voie passionnante et prometteuse pour lutter contre la résistance aux antibiotiques.
Article original: Payne, J.A.E., Tailhades, J., Ellett, F. et al. Antibiotic-chemoattractants enhance neutrophil clearance of Staphylococcus aureus. Nat Commun 12, 6157 (2021).
Autre sources:
Association for Professionals in Infection Control and Epidemiology. (2019, June 27). Staphylococcus aureus. APIC. https://apic.org/monthly_alerts/staphylococcus-aureus/
Ventola C. L. (2015). The antibiotic resistance crisis: part 1: causes and threats. P & T : a peer-reviewed journal for formulary management, 40(4), 277–283.
Wen, X., Xu, X., Sun, W., Chen, K., Pan, M., Wang, J. M., Bolland, S. M., & Jin, T. (2019). G-protein–coupled formyl peptide receptors play a dual role in neutrophil chemotaxis and bacterial phagocytosis. Molecular Biology of the Cell, 30(3), 346–356. https://doi.org/10.1091/mbc.e18-06-0358
Guerra, F. E., Borgogna, T. R., Patel, D. M., Sward, E. W., & Voyich, J. M. (2017). Epic immune battles of history: Neutrophils vs. Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology, 7. https://doi.org/10.3389/fcimb.2017.00286
BioRender. (n.d.). https://app.biorender.com
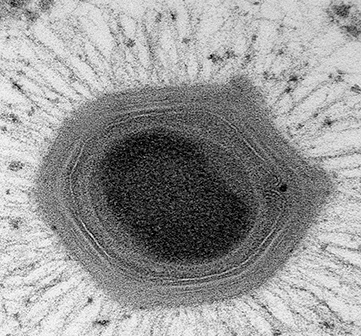
Featured image: Scanning electron micrograph of a human neutrophil ingesting Methicillin-Resistant Staphylococcus aureus (MRSA; purple). Link here
Traduit par Anaïs Biclot