De la microbiologie pour ceux qui ont les crocs
La mort de Bacillus subtilis donne naissance à de nouvelles structures cellulaires.
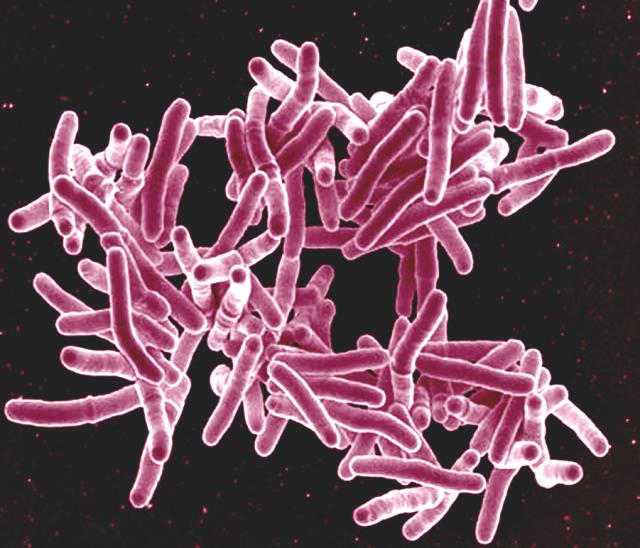
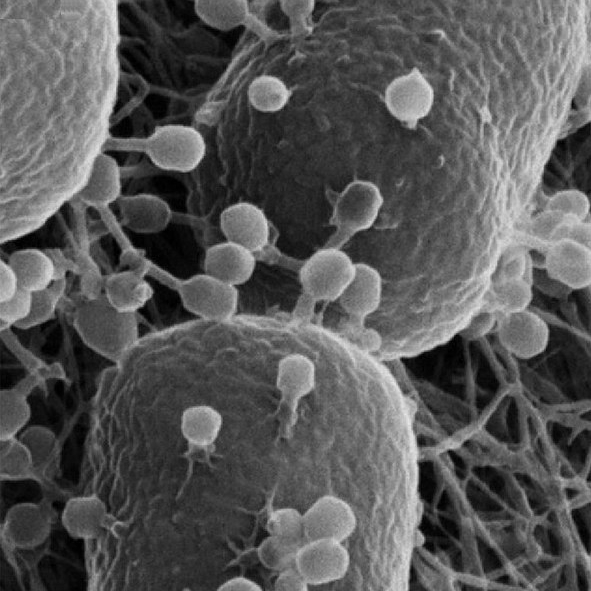
Malgré leur structure simple, les bactéries ne cessent de surprendre les scientifiques par leurs mécanismes particuliers de survie et d’adaptation. Les pili et les flagelles sont les structures bactériennes les plus connues, et probablement les plus étudiées. Pour vous rafraîchir rapidement la mémoire sur la composition d’une cellule bactérienne, les pili sont des structures courtes, ressemblant à des cheveux, qui sont responsables de l’adhérence aux surfaces. Certains types de pili participent même à la réplication bactérienne. Les flagelles, quant à eux, sont des structures rigides qui permettent la mobilité de nombreuses bactéries. Mais avez-vous déjà entendu parler des nanotubes ? On les trouve chez la bactérie Bacillus subtilis et, contrairement aux autres appendices cellulaires dont nous venons de parler, ces structures sont uniquement composées de lipides qui constituent une membrane cytoplasmique. La composition lipidique est assez rare pour un organite, mais elle permet une flexibilité accrue et un assemblage rapide.
Il existe deux classes de nanotubes bactériens que l’on trouve spécifiquement chez B.subtilis. Les nanotubes extensibles sont responsables de l’augmentation de la surface d’une cellule, ce qui permet aux bactéries d’absorber les nutriments de l’environnement. Les nanotubes intercellulaires créent un lien entre les cellules de deux espèces bactériennes ou peuvent même connecter des bactéries à des cellules eucaryotes.
Pospíšil et ses collègues ont mené une étude dans laquelle ils ont examiné les gènes et les conditions environnementales nécessaires à la formation de nanotubes chez B.subtilis. À la lecture du mot “tubes”, il serait facile de penser que ces structures sont responsables du transfert de nutriments ou de matériel génétique. Après tout, les bactéries vivent en communautés, où les cellules partagent les ressources acquises.
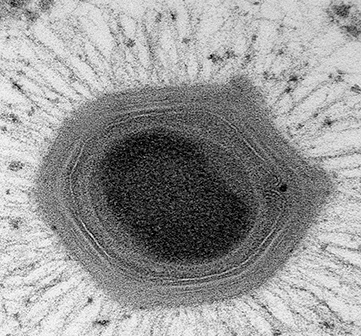
Il s’avère toutefois que les nanotubes ne se forment que dans des conditions de stress. Plus important encore, ces structures se développent lorsque les cellules sont en train de mourir ou même après leur mort. Elles ne servent pas de canaux de transport, mais sont plutôt le signe de la désintégration des cellules. Cette conclusion a été tirée à l’issue de l’expérience, au cours de laquelle les chercheurs ont pressé une lamelle contre des bactéries afin de créer une monocouche, c’est-à-dire une couche unique d’une cellule d’épaisseur. L’application d’une pression à partir d’un couvre-objet suffit à induire une réaction de stress chez les bactéries et à déclencher le processus d’assemblage des nanotubes. Mais combien de temps prend ce processus ? La réponse peut vous surprendre. Il ne faut que quelques secondes pour que ces nanotubes s’assemblent et apparaissent ! Dès que les chercheurs ont enregistré une diminution du signal provenant d’une membrane cellulaire, la formation de nanotubes a augmenté. Ils ont donc supposé qu’une fois que les cellules commencent à mourir et à se désagréger, les points faibles qui se produisent servent de canaux par lesquels les nanotubes émergent.
Pour percer le mystère des nanotubes bactériens, les chercheurs ont étudié les mécanismes génétiques qui régulent la formation de ces structures. Lorsqu’une cellule bactérienne subit un stress, elle s’adapte à ces conditions ou, lorsque le stress est trop important, elle meurt. Dans les situations où une cellule ne parvient pas à s’adapter aux conditions de stress, le facteur de transcription SigD devient essentiel. Avec l’aide d’un groupe de gènes, appelés gènes de l’élément CORE, ce facteur accélère le processus de transcription des gènes. En outre, comme nous l’avons déjà mentionné, les nanotubes sont composés de lipides, et non de protéines comme le reste des organites d’une cellule. Pour affaiblir et briser la paroi cellulaire, les autolysines LytE et LytF sont nécessaires. Les autolysines sont des enzymes qui décomposent les composants des cellules bactériennes.
Il est intéressant de noter que d’autres espèces bactériennes possèdent des structures similaires qui émergent de cellules mourantes (par exemple, un autre représentant du genre Bacillus, Bacillus megaterium ou Escherichia coli). Et une fois encore, ces organismes ont besoin d’un facteur de stress quelconque pour induire la formation de nanotubes. Si les auteurs de l’article concluent que les nanotubes de B.subtilis sont une caractéristique des cellules mourantes ou mortes, ils ne s’empressent pas de supposer qu’il en va de même pour les autres espèces bactériennes. Ils concluent que d’autres recherches doivent être menées pour déduire le rôle physiologique des nanotubes dans d’autres organismes.
Article original: Pospíšil, J., Vítovská, D., Kofroňová, O. et al. Bacterial nanotubes as a manifestation of cell death. Nat Commun 11, 4963 (2020).
Image: https://www.nature.com/articles/s41467-017-00344-7/figures/3
Traduit par: Anaïs Biclot