De la microbiologie pour ceux qui ont les crocs
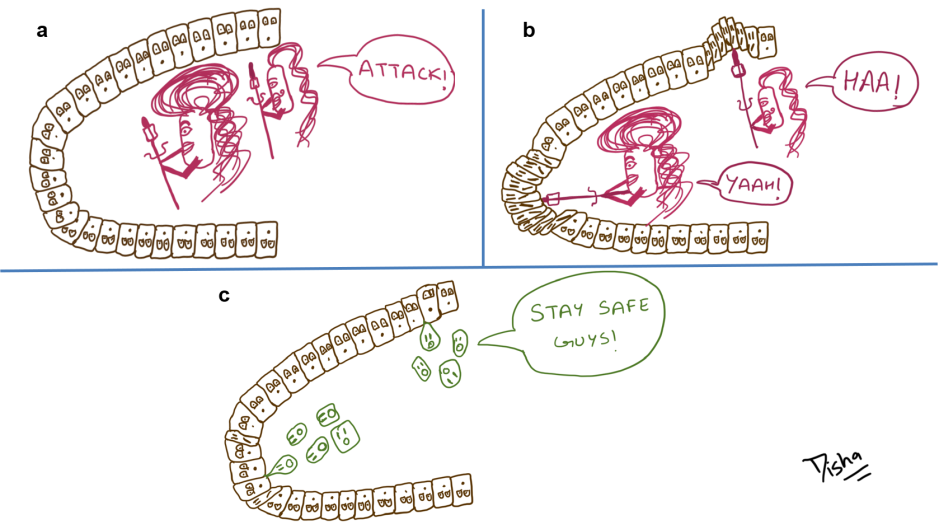
Stratégie d’attaque 101 du phage débutant SI01
Saviez-vous que les algues assurent 50 % de la production mondiale d’oxygène par photosynthèse ? Les algues collaborent avec les bactéries dans les océans et constituent la clé de voûte du cycle du carbone marin. Les bactéries fournissent généralement des nutriments inorganiques permettant la croissance des algues, tandis que ces dernières fournissent du carbone organique aux bactéries. L’interaction constante entre les deux, façonnée par elles-mêmes et/ou par l’environnement, est dynamique et intrigante, surtout pour ceux qui souhaitent connaître les secrets des mers et explorer la biogéochimie marine.
Pas toutes les algues ne ressemblent à de l’écume à la surface de l’eau ; certaines sont très belles à regarder, surtout à travers les “yeux” d’un microscope. Les diatomées, par exemple, sont communément appelées “opales vivantes”. Ce sont les seules algues dont les parois cellulaires sont ornées de motifs complexes et frappants de silice transparente et opaline. Thalassiosira pseudonana est une diatomée de ce type et constitue un organisme modèle privilégié pour les études sur les algues, notamment les études d’interaction avec d’autres organismes comme les bactéries.

Comme toutes les interactions algues-bactéries coexistant depuis le début de l’évolution, la diatomée Thalassiosira pseudonana s’associe à des bactéries hétérotrophes (bactéries utilisant le carbone organique comme nourriture) pour former un biofilm.
Fait interessant: on estime que les virus lysent quotidiennement environ 20 % de la biomasse microbienne des océans. En lysant les bactéries, ils influencent fortement le taux de mortalité bactérienne en les éliminant complètement ou de manière régulée. Par ce biais, les phages régulent les interactions algues-bactéries dans les biofilms – à la fois directement et indirectement, puisque ces mêmes bactéries influencent souvent négativement la croissance des diatomées.

Les centres de lyse des phages se trouvent dans des zones riches en nutriments entourant les cellules d’algues et favorisant les interactions entre algues et bactéries, appelées phycosphères. Comme la phycosphère présente un niveau microbien plus élevé que l’eau qui l’entoure, elle est plus sensible à la lyse par les virus.
Il est intéressant de noter que la phycosphère des algues est souvent dominée par quelques lignées bactériennes spécifiques. Ces bactéries forment activement des interactions chimiques symbiotiques avec les algues hôtes, influençant ainsi la propagation des algues.
Dans la phycosphère, les cellules bactériennes se désintègrent lorsqu’elles sont ciblées par des phages. Cela conduit à une augmentation des niveaux de nutriments organiques et inorganiques dans la zone. Par conséquent, le microbiote de l’environnement marin se modifie, car le microbiote non infecté (par des phages) est stimulé et les algues présentes ont désormais un meilleur accès aux nutriments dans cette zone.

En 2022, un groupe de scientifiques chinois a exploré l’interaction entre ces trois organismes : la diatomée Thalassiosira pseudonana, la bactérie Stappia indica SNL01 et le phage SI01.
Au cours de leurs recherches, les chercheurs se sont aperçus que parmi toutes les bactéries hétérotrophes associées à la diatomée Thalassiosira pseudonana, la bactérie Stappia indica SNL01 était celle qui était étroitement associée à la diatomée. Ils ont constaté que c’était cette bactérie en particulier qui inhibait la croissance de la diatomée en formant un biofilm. Ils ont été surpris de constater que cette bactérie récalcitrante ne pouvait être éliminée par de simples traitements mécaniques et antibiotiques.
Le genre bactérien Stappia est bien connu pour les gènes uniques et fonctionnellement importants de son répertoire. Par exemple, on a découvert que le sidérophore de type rhizobactine pour le piégeage du fer favorisait l’interaction de la bactérie avec les algues.
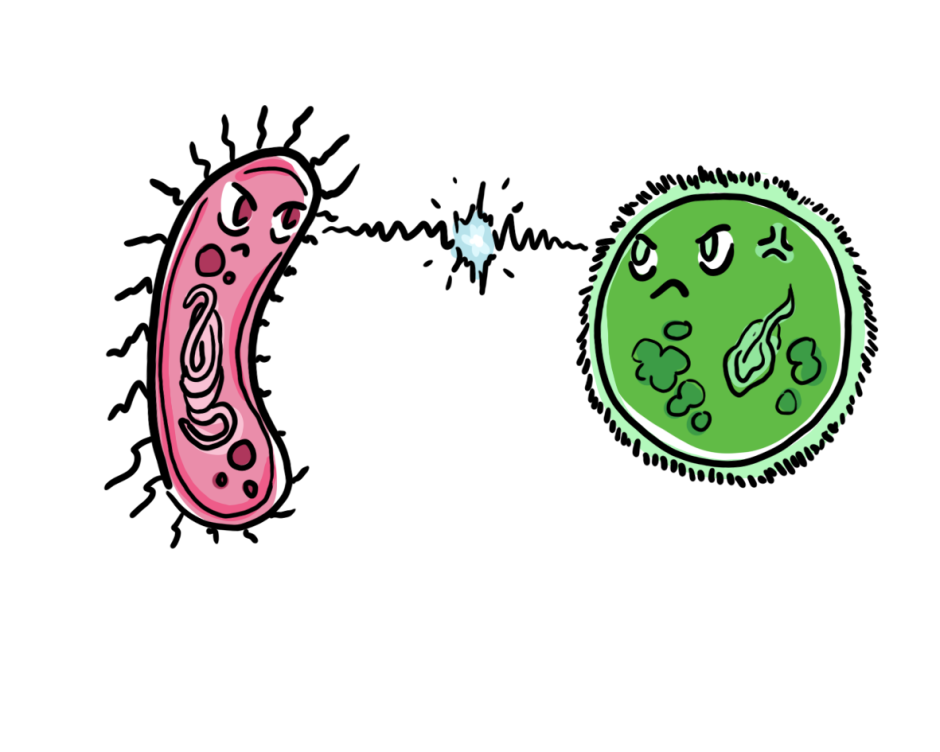
Dans leur étude, les scientifiques ont isolé un nouveau phage – SI01 – dans l’eau de mer côtière recueillie à Qingdao, en Chine. Ils ont sélectionné ce phage pour sa capacité à cibler Stappia indica SNL01. Ils ont constaté que le phage pouvait contrer l’inhibition de la croissance par Stappia indica SNL01, en “lysant” ou en décomposant le coupable, empêchant ainsi la formation du biofilm. Cela a fini par favoriser indirectement la croissance des diatomées. Comme les hôtes bactériens et algaux sont très liés dans les biofilms, la régulation par les phages peut donc affecter profondément l’hôte algal (diatomée) également.
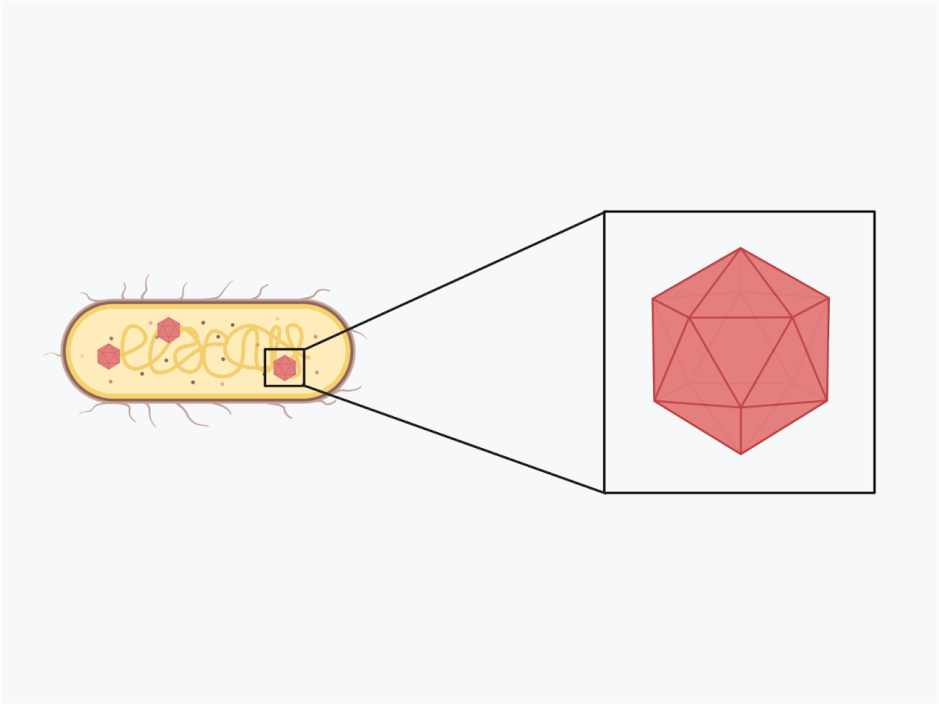
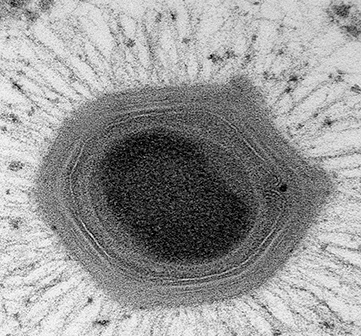
Le phage SI01 est un nouveau membre de la famille des virus Podoviridae (détecté par des études phylogénétiques). Comme tous les membres précédents des Podoviridae, ce phage débutant ne contient pas de lipides dans ses capsides. Il possède de nombreux gènes de lyse tels que la muramidase (pour lyser la paroi cellulaire), la SleB (pour lyser la couche protectrice la plus externe des spores bactériennes dormantes appelée cortex), et la protéine de type dépolymérase (pour faciliter la liaison et la digestion des capsules par adsorption sur la bactérie).
Par le biais des virions qui attaquent la paroi cellulaire, les lysozymes et les muramidases ont un effet négatif sur l’agrégation et l’adhésion des bactéries, puis sur la formation de biofilms. La muramidase, en particulier, réduit l’adhésion dans les biofilms.
La protéine SleB dégrade le cortex des spores bactériennes. Ainsi, la présence de SleB et de protéines similaires dans les phages aide à pénétrer les populations bactériennes dormantes dans l’environnement des biofilms.
Les protéines dépolymérases ou les protéines ” tail spike/ fiber “, sont caractéristiques des virus de la famille Podoviridae. Elles sont capables de cliver les polysaccharides bactériens : polysaccharides capsulaires (CPS), exopolysaccharides (EPS), et/ou lipopolysaccharides (LPS), qui sont les principaux composants des biofilms. La présence de ces protéines dans le phage SI01 lui permet de lyser le biofilm de la bactérie Stappia indica SNL01 avec une grande efficacité.
De manière surprenante, malgré sa nature virulente, le génome du phage SI01 est dépourvu d’ARNt. Ceci est fascinant car ce fait contredit l’hypothèse précédente selon laquelle ces molécules (ARNt) sont nécessaires à la virulence.

Lorsque les scientifiques ont inoculé le phage SI01 avec la bactérie Stappia indica SNL01 sur une plaque de gélose molle, ils ont observé des taches claires de 0,5 à 1 mm dans les 12 heures suivant l’inoculation, indiquant la lyse bactérienne. Ils en ont déduit que le phage SI01 favorisait effectivement la croissance de la diatomée Thalassiosira pseudonana par la lyse bactérienne, comme le montrent les résultats.
Ils ont remarqué qu’à des concentrations plus élevées du phage, l’effet inhibiteur de croissance de Stappia indica SNL01 était supprimé lorsque le phage était introduit dans le système d’interaction Thalassiosira pseudonana-S. indica SNL01 (ressemblant à un biofilm).
Pour aller plus loin, les chercheurs ont analysé l’intensité de la chlorophylle de la diatomée, en corrélation avec l’abondance d’algues dans la mer. A partir des données obtenues, ils ont conclu que Stappia indica SNL01 inhibait la croissance de la diatomée Thalassiosira pseudonana à des concentrations plus élevées (106 à 107 cellules mL-1) comme le montre la figure ci-dessous (se référer aux lignes violettes et vertes dans le panneau a où l’intensité de la chlorophylle diminue et le panneau b où l’intensité de la chlorophylle augmente).

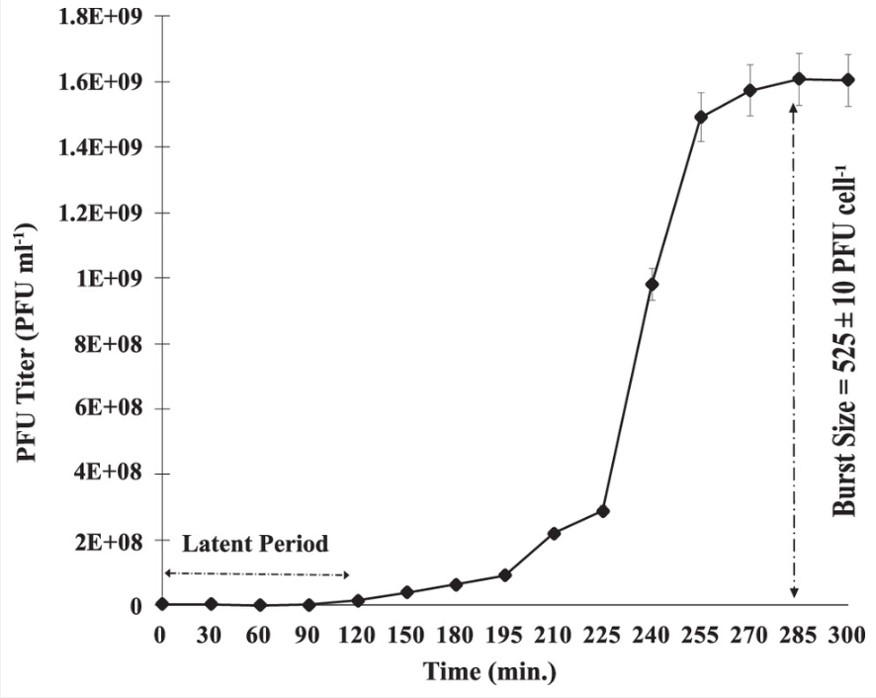
Pour mieux comprendre le cycle de croissance du virus SI01, une expérience de croissance en une étape a été réalisée. Cette expérience a permis de comprendre la durée des différentes phases du virus et d’analyser le schéma d’infection du phage SI01 dans Stappia indica SNL01. Les résultats ont montré que le virus avait une période de latence plus longue (120 min) par rapport aux autres phages Podoviridae marins, suivie d’une longue période d’éclatement d’environ 150 min. La longue période d’éclatement et la taille du virus, c’est-à-dire la durée et la quantité de virions produits par les cellules bactériennes infectées, reflètent la grande infectivité du virus.
En résumé, le phage SI01 est véritablement un débutant florissant dans le domaine de la microbiologie marine. Son isolement et les recherches ultérieures menées sur lui ont certainement contribué à une meilleure compréhension de l’impact de l’infection phagique sur la relation algues-bactéries dans les océans, qui était auparavant mal comprise. Sa capacité à s’adapter facilement (et étonnamment) aux fluctuations saisonnières et géographiques grâce à la stabilité inhérente de son pH et de sa température, fait de ce virus un mystère séduisant à explorer dans la recherche en virologie.
Article original: Shailesh Nair et al (2022). A Novel Phage Indirectly Regulates Diatom Growth by Infecting a Diatom-Associated Biofilm-Forming Bacterium. Applied and Environmental Microbiology, American Society for Microbiology Journal, 88(5). Doi: https://doi.org/10.1128/aem.02138-21
Featured image: Made with BioRender.com and icons created by ultimatearm and Nikita Golubev available on flaticon.
Traduit par Anaïs Biclot