Déterminer la causalité entre les maladies et le microbiote intestinal est un défi. Mais les animaux modèles peuvent nous aider.

De la microbiologie pour ceux qui ont les crocs
Petits animaux, grandes conclusions.
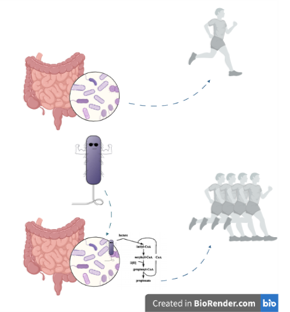
Déterminer le lien entre l’étiologie/le pronostic des maladies chroniques et le microbiome est encore difficile à faire. Les scientifiques ont essayé plusieurs méthodes pour déterminer le rapport de causalité qui pourrait expliquer l’association entre microbes et maladies. Une de ces méthodes sont les modèles murins associés au microbiote humain (Human Microbiota Associated – HMA).
Les modèles murins HMA sont des souris sans germes (des souris qui ont grandi dans un environnement stérile) qui reçoivent de la matière fécale de patients diagnostiqués avec une maladie chronique et/ou des volontaires sains. Si la maladie se manifeste seule dans les rongeurs après la transplantation à partir du patient malade, c’est alors qu’il y a une base pour un rapport de causalité. Malheureusement, c’est tout ce qu’on peut dire sur cette méthode qui manque de standardisation. Les avantages et inconvénients de cette méthode ont été explorés par Walter et ses collaborateurs dans une revue systématique de 38 études.
Tout d’abord, les auteurs ont établis la liste des avantages à utiliser les modèles murins HMA :
- La possibilité d’avoir un aperçu des mécanismes des pathologies dans les rougeurs après avoir reçu la matière fécale tout en étant capable de contrôler les facteurs environnementaux tels que leur habitat et nourriture.
- La possibilité de comparer la réponse du rongeur aux communautés microbiennes venant d’un volontaire sain contre la réponse d’une donation venue d’un patient malade.
- La facilité d’observer ces communautés microbiennes grâce aux technologies de séquençage comme le séquençage métagénomique pour suivre l’évolution ainsi que déterminer les différences de composition des microbiotes intestinaux pendant l’expérience.
Ces modèles devraient nous permettre d’explorer convenablement le rapport de causalité entre le microbiome et les maladies. Cependant, les auteurs soulignent quelques limitations associées avec ce modèle et donnent des suggestions sur comment l’améliorer.
Intégrité du microbiome des donneurs. Les microbes venant d’un donneur humain ne réussissent pas toujours à coloniser l’appareil gastro-intestinal des rougeurs receveurs. Le peu de taxa qui réussissent la colonisation crée une base qui peut fortement faire varier la composition finale du microbiome. Les auteurs montrent que certaines études admettent que la composition du microbiome venue du donneur humain est changée mais affirment quand même des associations entre le microbiome et les maladies. Il est important de vérifier si oui ou non les microbiomes des rongeurs représentent suffisamment celui des donneurs.


Les modèles. Le microbiote intestinal se montre important dans le développement du système immunitaire et du système nerveux. Étant donné que les rongeurs sont élevés dans un environnement stérile, ils sont susceptibles d’avoir des problèmes immunologiques et neurologiques. De plus, le système immunitaire des rongeurs est différent de celui des humains, ce qui fait qu’ils ne sont pas de bons modèles pour représenter les problématiques du système immunitaire humain si l’on veut étudier le lien entre microbes et maladies auto-immunes. Ce problème peut être adressé si les rongeurs sont humanisés en incorporant des cellules immunitaires humaines ou en utilisant d’autres modèles plus proches de l’humain comme le singe ou le cochon.

Homogénéiser des maladies hétérogènes. Les méthodes pour créer et concevoir des expériences avec des modèles murins HMA peuvent varier grandement. Chaque microbiome individuel est unique, comme une empreinte. Malgré cela, il y a beaucoup d’études qui regroupent les échantillons des donneurs, ce qui peut effacer les caractéristiques individuelles associées avec le statut ou la sévérité de la maladie. Il est donc important de s’assurer que le nombre de donneurs est suffisant pour représenter la variation biologique rencontrée chez les patients.
Tout est dans le nombre. Un autre élément important est l’implication statistique de regrouper les donneurs de matière fécale. Quand il y a plus de rongeurs que de donneurs, les résultats sont surreprésentés. Par exemple, si dans la réalité, seulement peu de personnes avec la maladie ont la bactérie A, alors avec le regroupement des donneurs, les résultats de l’expérience vont indiquer que tout le monde qui a la maladie devrait avoir beaucoup de cette bactérie A. Les articles de recherche avec des statistiques les plus exactes sont donc ceux qui ont un nombre équivalent de donneurs et de receveurs.
Pour conclure, le modèle murin HMA n’est pas la seule approche pour étudier le rapport de causalité. Des avancées dans les modèles statistiques qui infèrent la causalité et les études qui conduisent à une modulation directe du microbiome humain sont de nouvelles méthodes pour mieux comprendre l’interface entre le microbiome et la maladie. La combinaison de ces techniques en plus d’un usage standardisé des modèles HMA permetteront de produire des résultats intéressants dans le futur.
Doi: 10.1016/j.cell.2019.12.025
Traduit par Anaïs Biclot