De la microbiologie pour ceux qui ont les crocs
Vos bactéries intestinales sont de petits entrepôts de médicaments.
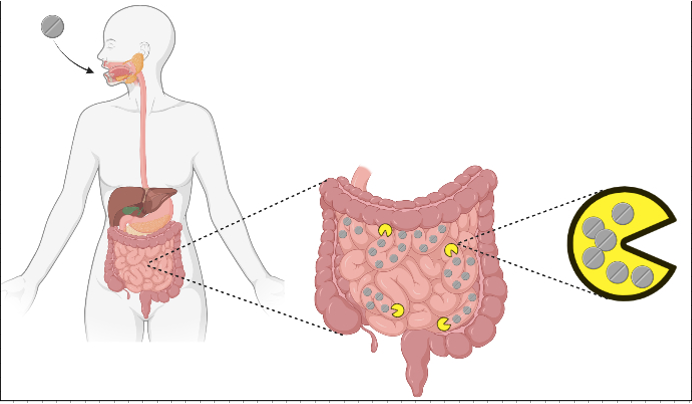
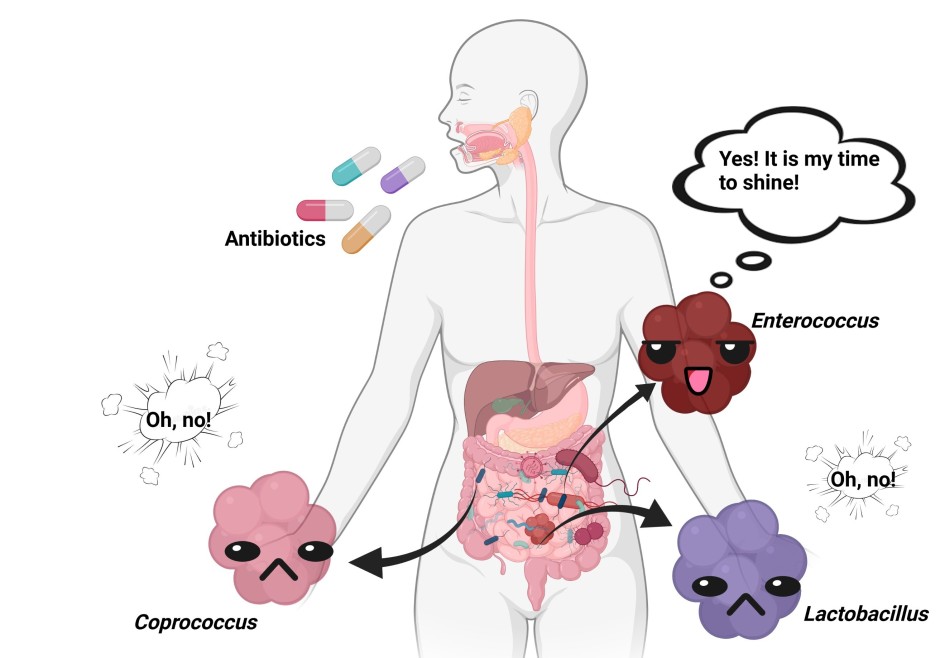
Vous savez probablement déjà que les médicaments peuvent avoir un effet (négatif) sur le microbiome intestinal. Mais savez-vous que notre microbiome intestinal peut affecter à la fois la disponibilité et l’efficacité des médicaments thérapeutiques ? Vous avez bien lu, l’interaction bactéries-médicaments est à double sens. Le principal mécanisme par lequel les bactéries influencent la disponibilité des médicaments est la biotransformation, ou la transformation chimique des médicaments par les micro-organismes. En 2019, une étude a rapporté que plus de cent molécules de médicaments étaient chimiquement transformées par nos bactéries intestinales. Ce processus a des résultats différents selon la bactérie et le médicament. Par exemple, la lovastatine et la sulfasalazine sont transformées en leurs formes actives, mais l’inverse est vrai pour la digoxine. Malgré les preuves croissantes de l’effet sur l’activité et l’efficacité des médicaments, ainsi que sur l’aptitude microbienne, la cartographie systématique de ces interactions médicament-bactérie n’a commencé que récemment.
La bioaccumulation par les bactéries intestinales…
Dans le but d’élargir nos connaissances sur ce sujet, Klümann et al. ont établi le profil des interactions entre 15 (12 + 3 contrôles) médicaments à usage humain et 25 souches représentatives de bactéries intestinales humaines (figure 1).
Figure 1. Représentation schématique du montage expérimental pour le profilage de l’interaction bactéries-médicaments. Image créée par l’auteur avec BioRender.com d’après la description de la méthode dans l’article original.
A gauche: 25 souches de bactéries et 15 médicaments combinés, a droite les chercheurs ont soit analyser la partie liquide pour mesurer la biodisponibilité des médicaments (haut), ou les cellules bacteriennes pour mesurer la biotransformation (milieu) ou la bioaccumulation (bas).
Les 375 paires bactéries-médicaments obtenues ont révélé 70 interactions bactéries-médicaments, dont 29 qui n’avaient pas été signalées auparavant (figure 2). Fait intéressant, 17 de ces 29 interactions nouvellement identifiées se sont avérées être des événements de bioaccumulation, ou de stockage du médicament par les bactéries sans le modifier, plutôt que des événements de biotransformation. En outre, l’étude a montré que les interactions entre la biotransformation et la bioaccumulation ne s’excluent pas mutuellement.
Figure 2. Réseau d’interaction bactéries-médicaments identifié dans l’étude. Réseau de gauche : biotransformation ou bioaccumulation des médicaments par les bactéries intestinales. Réseau de droite : l’effet des médicaments sur la croissance des bactéries intestinales. Crédits image : Klünemann, M., Andrejev, S., Blasche, S. et al. Bioaccumulation de médicaments thérapeutiques par les bactéries intestinales humaines. Nature 597, 533-538 (2021). https://doi.org/10.1038/s41586-021-03891-8
Le mécanisme de la biotransformation des médicaments est concevable (indice : enzymes métaboliques), mais qu’en est-il de la bioaccumulation des médicaments ? Pour étudier la base moléculaire de l’accumulation des médicaments, Klümann et al. ont étudié les cibles protéiques de la duloxétine dans différentes souches bactériennes intestinales bioaccumulatrices. À l’aide de techniques telles que le pull down par chimie click (“clipsage d’une molécule sur une autre”) et le profilage thermique du protéome (TPP) , ils ont trouvé plusieurs protéines enzymatiques qui réagissent structurellement à la duloxétine. Outre l’identification des protéines cibles, les chercheurs ont également montré que la liaison de la duloxétine à ces enzymes métaboliques bactériennes modifiait le métabolisme des souches bioaccumulatrices (figure 3). Ainsi, la bioaccumulation n’a pas seulement un impact sur la biodisponibilité du médicament, mais modifie également la physiologie cellulaire des bactéries accumulatrices de médicaments !
Figure 3. A gauche : représentation schématique des modifications métaboliques par bioaccumulation. Un médicament à petite molécule tel que la duloxétine se lie structurellement à une protéine bactérienne “cible”, ce qui affecte la fonction de cette dernière. A droite : Voie de biosynthèse des nucléotides (c’est-à-dire une voie métabolique bactérienne importante) chez le C. saccharolyticum en cours de bioaccumulation, marquant les enzymes se liant à la duloxétine (test pull down par chimie click, bleu) ou y répondant (test TPP, orange). Les métabolites sécrétés de manière différentielle (c’est-à-dire la mesure de l’altération du métabolisme) sont soulignés. Image créée dans BioRender.com ; voie de synthèse des nucléotides copiée de Klünemann, M. et al.
…et ses conséquences.
Les interactions métaboliques jouent un rôle fondamental dans le façonnement de la composition des communautés microbiennes intestinales. On peut donc se demander si les changements métaboliques associés à la bioaccumulation affectent également la composition de la communauté. Klümann et al. se sont penchés sur cette question en assemblant des communautés stables composées de cinq espèces bactériennes intestinales, dont un bioaccumulateur de duloxétine (Streptococcus salivarius) et une espèce directement inhibée par la duloxétine (Eubacterium rectale). Ils ont constaté que la présence de la duloxétine modifiait sensiblement la composition de la communauté, entraînant une multiplication par 100 de l’abondance d’E. rectale (figure 4). Bien que la bioaccumulation de la duloxétine par S. salivarius puisse conférer un effet protecteur sur E. rectale, l’augmentation de la bactérie en présence du médicament nécessiterait des interactions favorisant la croissance. Ici, Klümann et al. ont montré que la sécrétion d’un métabolite modifié par S. salivarius sous l’effet de la duloxétine a stimulé la croissance d’E. rectale, permettant à la bactérie de proliférer (figure 5). Ainsi, les médicaments à visée humaine peuvent moduler les communautés microbiennes intestinales 1) par l’inhibition directe de certains membres de la communauté, et 2) par la modification des interactions métaboliques entre les bactéries d’une communauté.
Figure 4. La bioaccumulation de la duloxétine modifie la composition de la communauté. Crédits d’image : Klünemann, M. et al.
Figure 5. La bioaccumulation de la duloxétine par S. salivarius provoque la prolifération d’E. rectale. Image créée par l’auteur avec BioRender.com
Enfin, comment la bioaccumulation affecte-t-elle la réponse de l’hôte au médicament ? Pour étudier cette question, Klümann et al. ont examiné la réponse de C. elegans à la bioaccumulation de la duloxétine. Comme la duloxétine régule le comportement (mouvement musculaire), les chercheurs ont utilisé le mouvement des animaux comme indicateur. Leur expérience a montré que la présence de souches bioaccumulatrices de duloxétine affectait la réponse de l’hôte en atténuant l’effet thérapeutique de la duloxétine (la duloxétine ralentit les mouvements ; bioaccumulation de la duloxétine dans les microbes → diminution de la disponibilité pour les cellules cibles de l’hôte → moins d’effet → plus de mouvements observés).
En conclusion, Klüman et al. ont découvert deux façons dont la bioaccumulation par les bactéries intestinales peut modifier l’effet thérapeutique des médicaments ciblés par l’hôte : 1) une disponibilité réduite du médicament et 2) une sécrétion modifiée de métabolites bactériens. Cette sécrétion modifiée de métabolites peut entraîner des changements dans la composition de la communauté, ce qui est associé à des effets secondaires, et interfère potentiellement avec le mode d’action de certains médicaments. Ainsi, la cartographie de ces interactions réciproques entre les médicaments et les bactéries peut nous aider à mieux prévoir les modifications de la disponibilité des médicaments et du métabolisme bactérien, ainsi que les implications pour la composition du microbiote, la pharmacocinétique, les effets secondaires et les réponses de l’hôte aux médicaments.
Featured image: Image created by author with BioRender.com
Traduit par Anaïs Biclot