De la microbiologie pour ceux qui ont les crocs
Les harpons bactériens
Les bactéries vivent rarement dans des environnements isolés. En général, les écosystèmes sont peuplés de différentes espèces de bactéries, de champignons et d’autres organismes, qui se disputent souvent les mêmes ressources pour survivre. Certaines bactéries ont donc développé un moyen ingénieux de se donner un avantage concurrentiel : des nanomachines moléculaires qui agissent comme des ‘harpons’ protéiques. De même qu’un fusil à harpon est muni d’un ressort et d’un verrou rigide et prêt à faire feu lorsqu’on appuie sur la gâchette, ces nanomachines bactériennes sont déployées et prêtes à envoyer un tube interne rempli de marchandises dans leur environnement ou directement dans des cellules cibles.
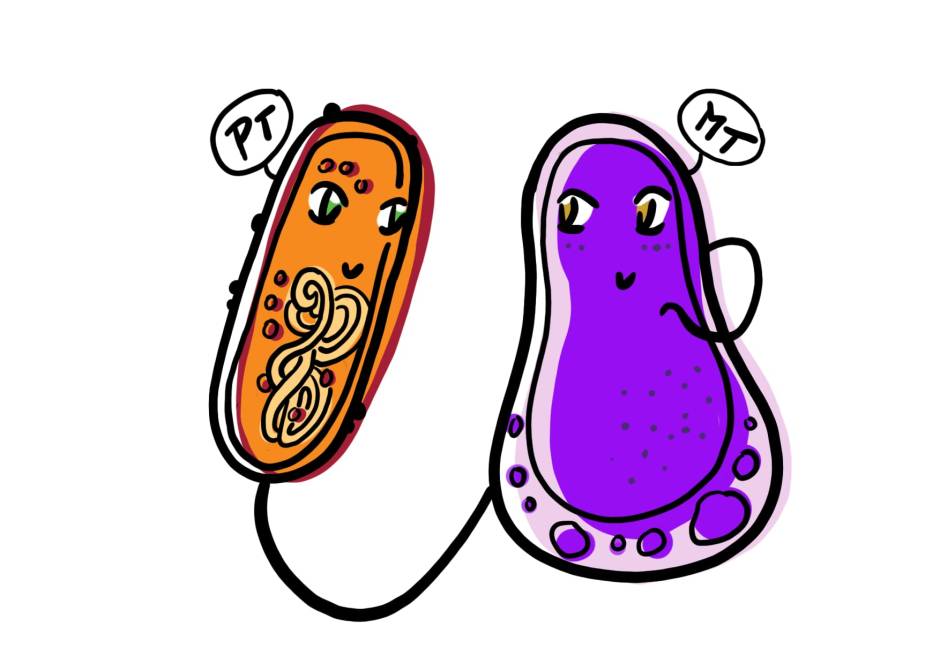
Auparavant, des exemples de ces fusils d’assaut bactériens, ou systèmes d’injection contractiles (CIS pour contractile injection systems en anglais) comme on les appelle dans le domaine, se sont avérés avoir un effet direct sur d’autres organismes dans leur environnement. Par exemple, un CIS de Serratia entomophila a été baptisé “prophage anti-fécondation” ou AFP en raison de sa capacité à stopper l’activité alimentaire des larves d’insectes en injectant une toxine insecticide lors de son ingestion. De même, les “structures contractiles associées à la métamorphose” (MAC) produites par Pseudoaltermonas luteoviolacea existent sous la forme d’un réseau de centaines de ces CIS, ancrées ensemble à leurs extrémités, leurs “lances” pointant vers l’extérieur, prêtes à faire feu. Lorsque les CIS rencontrent le ver marin Hydroides elegans, ils injectent des molécules qui provoquent la métamorphose des vers – transformant les larves de vers nageant librement en vers tubulaires adultes et adhésifs qui se collent aux rochers, aux coraux et aux coques des navires. Récemment, des publications consécutives dans Nature Microbiology ont décrit la découverte de deux nouveaux CIS produits par des bactéries aquatiques.
Les cyanobactéries multicellulaires produisent des CIS dans de nouveaux endroits
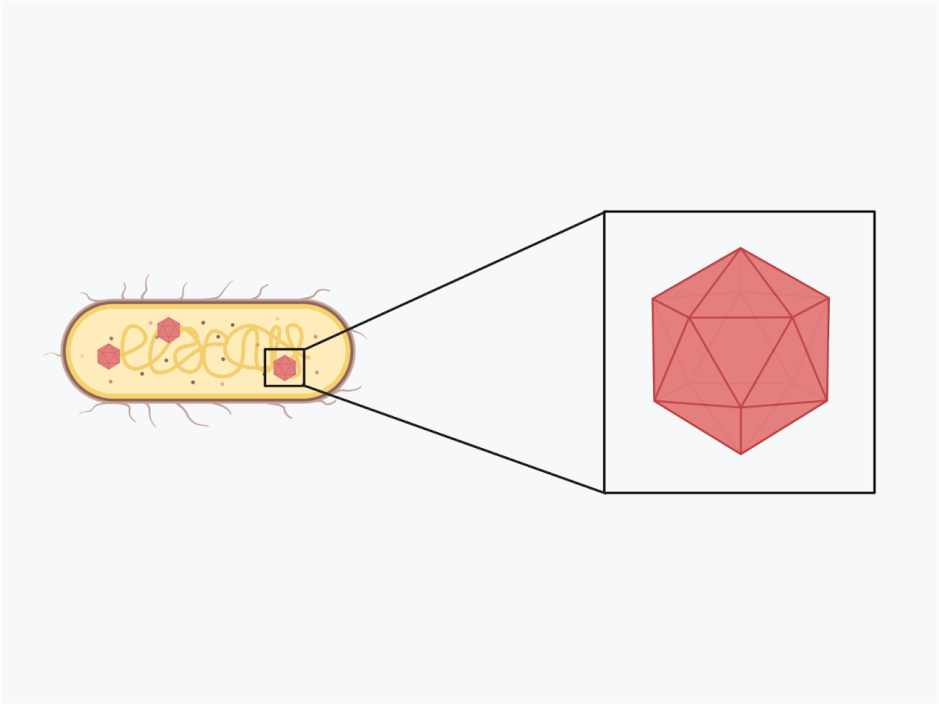
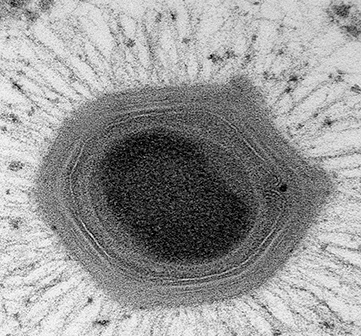
Les cyanobactéries, communément appelées algues bleues, sont l’un des organismes les plus abondants de la planète. Capables de photosynthèse, ces bactéries aux multiples facettes peuvent se développer dans toute une série d’environnements : des sols humides aux eaux douces et salées. Elles peuvent exister sous forme de cellules uniques, de filaments et même de feuilles, et interagir étroitement avec d’autres microbes. Récemment, des chercheurs ont pu utiliser des microscopes électroniques pour visualiser des filaments de cyanobactéries et ont découvert quelque chose d’intéressant : à l’intérieur des chloroplastes se trouvaient des CIS intégrés dans les membranes thylakoïdes, les parties de la cellule où la photosynthèse a lieu dans la bactérie. Les CIS précédemment classés étaient soit ancrés à la membrane cellulaire externe, soit flottant librement au milieu des cellules ; ces CIS ancrés dans les thylakoïdes, ou tCIS, constituent une classe entièrement nouvelle et passionnante de CIS. Lorsque les cyanobactéries sont soumises à un stress, par exemple en raison d’une forte concentration de sel dans l’environnement ou d’une exposition aux rayons ultraviolets, les couches externes de la cellule sont éliminées (créant ce que l’on appelle une “cellule fantôme”), exposant les tCIS tournés vers l’extérieur qui sont prêts à tirer au contact d’une cible.

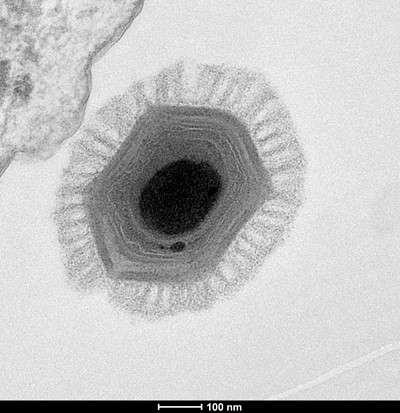
En isolant des tCIS individuels des cyanobactéries, les chercheurs ont également pu découvrir exactement quelles protéines composent ces nouveaux canons à épée et utiliser un microscope électronique pour visualiser les atomes individuels – ce qui leur a permis de construire un modèle 3D d’un tCIS. L’élaboration de ces modèles permet aux chercheurs d’identifier les parties importantes du CIS qui lui confèrent des capacités uniques, comme l’ancrage dans la membrane thylakoïde de la cellule, le choix des cibles et l’envoi de molécules cargo spéciales lors de la contraction.
Libérer le CIS : visualiser le CIS à l’extérieur de la cellule
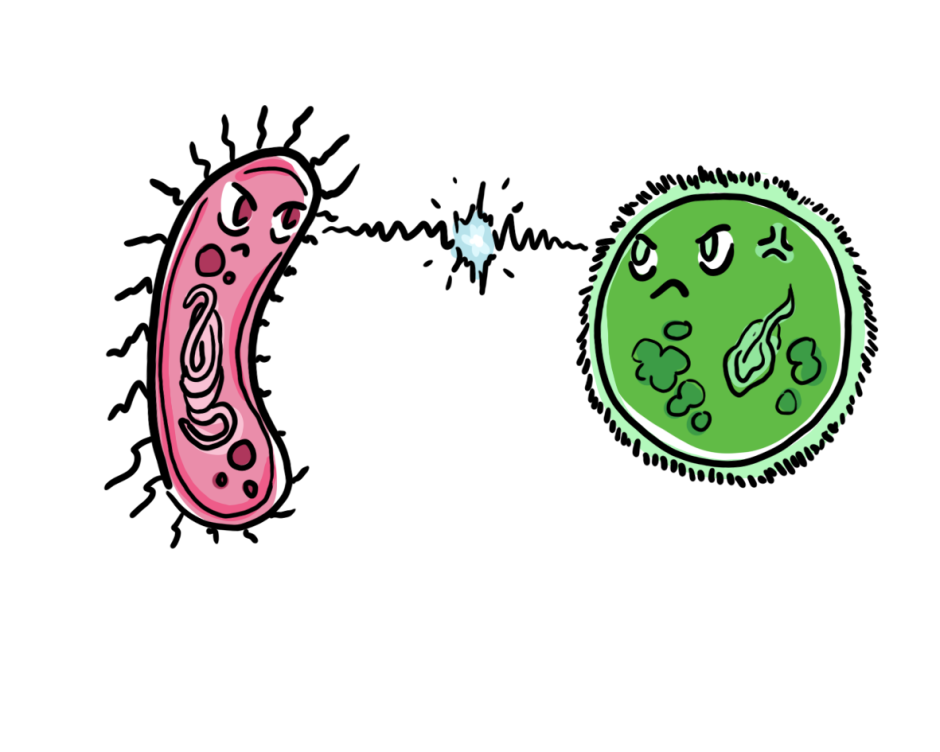
Par ailleurs, le groupe a également découvert un autre CIS qui n’était pas du tout ancré à une membrane, mais flottait librement à l’intérieur de la bactérie et était ensuite libéré dans l’environnement. Ce CIS, qui se trouve à l’extérieur de la cellule ou “extracellulairement” (eCIS), produit par Algoriphagus machipongonensis est libéré dans l’environnement pour cibler d’autres cellules. En déterminant les composants de cet eCIS, ils ont découvert des caractéristiques uniques qui n’avaient pas été identifiées auparavant dans les CIS, comme un “adaptateur de capuchon” qui se place sur le dessus du tube interne du CIS pour le sceller, une protéine “bouchon” interne qui agit pour boucher le tube interne, et une “cage de pointe” qui recouvre la protéine de pointe, aidant à cibler et à prévenir les tirs prématurés. Ces caractéristiques donnent des indices sur l’évolution des CIS et sur la raison pour laquelle ils produisent tant de types différents de structures contractiles avec des parties et des fonctions différentes.

Applications en biomédecine
Ces bactéries ont développé des nanomachines moléculaires spécialisées qui leur permettent d’interagir avec les organismes voisins dans leur environnement. En comparant les modèles 3D du tCIS et de l’eCIS récemment découverts avec les CIS précédemment identifiés chez d’autres bactéries, on constate que de nombreux CIS partagent des blocs de construction ou des modules communs. Dans cette optique, les chercheurs pourraient, à l’avenir, exploiter la nature modulaire de ces fers à cheval moléculaires, en les remodelant pour qu’ils ciblent des types de cellules spécifiques et même pour qu’ils envoient des médicaments ou des antimicrobiens spécifiques : créer des harpons moléculaires spécialisés pour éventuellement administrer des chimiothérapies ou des antibiotiques directement aux cellules.
Article original:
Image de couverture: Charles F. Ericson
Traduit par Anaïs Biclot