Deconstruyendo la microbiología mordisco a mordisco
Tus bacterias intestinales son pequeños depósitos de medicamentos.
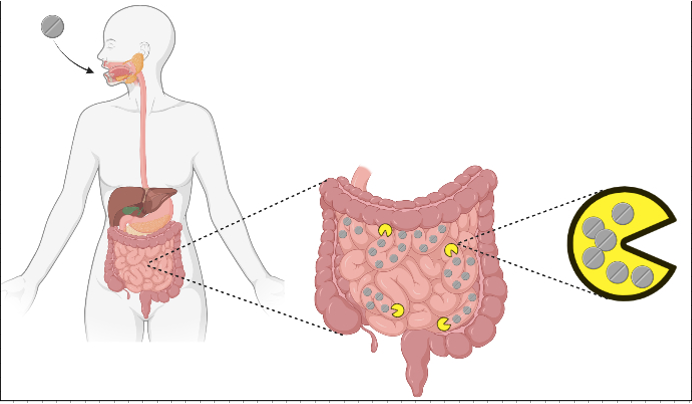
Probablemente ya sepas que los medicamentos pueden afectar (negativamente) a nuestro microbioma intestinal. ¿Pero sabes que nuestro microbioma intestinal puede afectar tanto a la disponibilidad como a la eficacia de los fármacos? Leíste bien, la interacción entre bacterias y fármacos es bidireccional. El principal mecanismo por el que las bacterias influyen en la disponibilidad de los fármacos es a través de la biotransformación, o la transformación química de los fármacos por parte de los microorganismos. En 2019, un estudio informó que más de cien moléculas de fármacos fueron transformadas químicamente por nuestras bacterias intestinales. Este proceso tiene diferentes resultados dependiendo de la bacteria y del fármaco. Por ejemplo, la lovastatina y la sulfasalazina se transforman en sus formas activas, pero ocurre lo contrario con la digoxina. A pesar de las crecientes pruebas del efecto sobre la actividad y la eficacia de los fármacos, así como sobre la supervivencia microbiana, el estudio sistemático de estas interacciones entre fármacos y bacterias sólo ha comenzado recientemente.
La bioacumulación por parte de las bacterias intestinales…
Con el objetivo de ampliar nuestros conocimientos sobre este tema, Klümann y colaboradores categorizaron las interacciones entre 15 (12 + 3 controles) fármacos dirigidos al ser humano y 25 cepas representativas de bacterias intestinales humanas (figura 1).
Representación esquemática del diseño experimental para categorizar la interacción bacteria-fármaco. Imagen creada por el autor con BioRender.com basada en la descripción del método en Klünemann, M., Andrejev, S., Blasche, S. et al. Bioaccumulation of therapeutic drugs by human gut bacteria. Nature 597, 533–538 (2021). https://doi.org/10.1038/s41586-021-03891-8.
Los 375 pares bacteria-fármaco resultantes revelaron 70 interacciones bacteria-fármaco, entre las que se encontraban 29 de las que no se había informado anteriormente (figura 2). Curiosamente, 17 de estas 29 interacciones recién identificadas resultaron ser eventos de bioacumulación, o almacenamiento del fármaco por parte de las bacterias sin modificarlo, en lugar de eventos de biotransformación. Además, el estudio demostró que las interacciones de biotransformación y de acumulación no eran mutuamente excluyentes.
Red de interacción bacteria-fármaco identificada en el estudio. Red de la izquierda: biotransformación o bioacumulación de fármacos por parte de las bacterias intestinales. Red de la derecha: efecto de los fármacos en el crecimiento de las bacterias intestinales. Créditos de las imágenes: Klünemann, M., Andrejev, S., Blasche, S. et al. Bioaccumulation of therapeutic drugs by human gut bacteria. Nature 597, 533–538 (2021). https://doi.org/10.1038/s41586-021-03891-8.
El mecanismo detrás de la biotransformación de los fármacos es concebible (una pista: enzimas del metabolismo), pero ¿qué pasa con la bioacumulación de fármacos? Para investigar la base molecular de la acumulación del fármaco, Klümann y colaboradores. estudiaron las proteínas blanco de la duloxetina en diferentes cepas bacterianas intestinales bioacumuladoras. Utilizando técnicas como el la “precipitación por química click” y la “caracterización térmica del proteoma” (TPP por sus siglas en inglés), encontraron varias enzimas que respondían estructuralmente a la duloxetina. Además de la identificación de las proteínas blanco, los investigadores también demostraron que la unión de la duloxetina a estas enzimas bacterianas alteraba el metabolismo de las cepas bioacumuladoras (figura 3). Así pues, la bioacumulación no sólo afecta a la biodisponibilidad del fármaco, sino que también modifica la fisiología celular de las bacterias que lo acumulan.
Izquierda: representación esquemática de los cambios metabólicos por bioacumulación. Un fármaco de molécula pequeña, como la duloxetina, se une estructuralmente a una proteína bacteriana “blanco”, lo que afecta a la función de esta última. A la derecha: Vía biosintética de los nucleótidos (es decir, una importante vía metabólica bacteriana) en el C. saccharolyticum bioacumulador, marcado en azul las enzimas que se unen a la duloxetina (ensayo de precipitación por química click) o que responden (ensayo TPP, en naranja). Los metabolitos secretados diferencialmente (es decir, la medida de la alteración del metabolismo) están subrayados. Imagen creada en BioRender.com; la vía de síntesis de nucleótidos fue copiada de Klünemann, M., Andrejev, S., Blasche, S. et al. Bioaccumulation of therapeutic drugs by human gut bacteria. Nature 597, 533–538 (2021). https://doi.org/10.1038/s41586-021-03891-8.
…y sus consecuencias.
Las interacciones metabólicas desempeñan un papel fundamental en la conformación de la composición de las comunidades microbianas del intestino. Esto plantea la cuestión de si los cambios metabólicos asociados a la bioacumulación también afectan a la composición de la comunidad. Klümann y colaboradores, abordaron esta cuestión reuniendo comunidades estables formadas por cinco especies bacterianas intestinales, entre ellas una bioacumuladora de duloxetina (Streptococcus salivarius) y una especie que es directamente inhibida por la duloxetina (Eubacterium rectale). Descubrieron que la presencia de la duloxetina cambiaba notablemente la composición de la comunidad, dando lugar a un aumento de 100 veces en la abundancia de E. rectale (figura 4). Aunque la bioacumulación de duloxetina por parte de S. salivarius puede conferir un efecto protector a E. rectale, el aumento de la bacteria en presencia del fármaco requeriría interacciones promotoras del crecimiento. En este caso, Klümann y colaboradores, demostraron que la secreción de metabolitos modificados mediada por la duloxetina por parte de S. salivarius impulsó el crecimiento de E. rectale, permitiendo que la bacteria floreciera (figura 5). Así pues, los fármacos dirigidos al ser humano pueden modular las comunidades microbianas intestinales 1) mediante la inhibición directa de ciertos miembros de la comunidad, y 2) mediante la modificación de las interacciones metabólicas entre las bacterias de una comunidad.
La bioacumulación de duloxetina altera la composición de la comunidad. Créditos de la imagen: Klünemann, M., Andrejev, S., Blasche, S. et al. Bioaccumulation of therapeutic drugs by human gut bacteria. Nature 597, 533–538 (2021). https://doi.org/10.1038/s41586-021-03891-8.
La bioacumulación de duloxetina por S. salivarius hace que E. rectale florezca. Imagen creada por el autor con BioRender.com basada en : Klünemann, M., Andrejev, S., Blasche, S. et al. Bioaccumulation of therapeutic drugs by human gut bacteria. Nature 597, 533–538 (2021). https://doi.org/10.1038/s41586-021-03891-8.
investigar esto, Klümann y colaboradores, examinaron la respuesta de C. elegans a la bioacumulación de duloxetina. Dado que la duloxetina regula el comportamiento (el movimiento muscular), los investigadores utilizaron el movimiento del animal como indicador. Su experimento demostró que la presencia de cepas bioacumuladoras de duloxetina afectaba a la respuesta del huésped atenuando el efecto terapéutico de la duloxetina (la duloxetina ralentiza los movimientos; bioacumulación de duloxetina en los microbios → menor disponibilidad para las células blanco del huésped → menor efecto → más movimientos observados).
En conclusión, Klüman y colaboradores, descubrieron dos formas en las que la bioacumulación por parte de las bacterias intestinales puede alterar el efecto terapéutico de los fármacos dirigidos al huésped: 1) reducción de la disponibilidad del fármaco, y 2) cambio en la secreción de metabolitos bacterianos. Este cambio en la secreción de metabolitos puede conducir a cambios en la composición de la comunidad, lo que se asocia con efectos secundarios, y potencialmente interfiere con el modo de acción de algunos fármacos. Por tanto, la descripción de estas interacciones recíprocas entre fármacos y bacterias puede ayudarnos a predecir mejor las alteraciones en la disponibilidad de los fármacos y el metabolismo bacteriano, así como las implicaciones para la composición de la microbiota, la farmacocinética, los efectos secundarios y las respuestas del huésped a los fármacos.
Link to the original post:
Featured image:
Image created by author with BioRender.com
Traducido por Gaby Bravo-Ruiseco