Microbiologie in hapklare porties
HIV bestrijden met CRISPR
Inleiding tot HIV
Tegen het einde van 2022 leven wereldwijd 39 miljoen mensen met een hiv-infectie, in de hoop op genezing. Het Human Immunodeficiency Virus (HIV) vernietigt ons immuunsysteem, waardoor ons lichaam vatbaar wordt voor verschillende infecties en ziekten. HIV richt zich op de CD4+ T-cellen – dat zijn witte bloedcellen (WBC) die ons lichaam helpen ziekten te bestrijden – en vernietigt deze. Momenteel is antiretrovirale therapie of ART de behandeling voor HIV-infectie. ART is een combinatie van antiretrovirale geneesmiddelen, d.w.z. geneesmiddelen die werken tegen retrovirussen zoals HIV, namelijk lamivudine, abacavir en andere. Hoewel ART de levensverwachting van hiv-positieve personen verhoogt en het risico op hiv-overdracht vermindert, vereist het een levenslange verbintenis. Daarom kan een onderbreking van de ART-routine leiden tot een snelle terugkeer van virussen in de bloedbaan, aangezien deze medicijnen alleen werken om het virus te onderdrukken.
Deze studie onderzoekt de CRISPR/Cas9 genbewerking voor de behandeling van HIV-1. Ten eerste, wat is CRISPR? Het staat voor Clustered Regularly Interspaced Short Palindromic Repeats. Het is een reeks herhalende sequenties in bacterieel DNA die toevallig overeenkomen met virale sequenties. Bij virale infectie in een bacteriële cel wordt de bacteriële DNA-sequentie omgezet in RNA, dat fungeert als een ‘gids’ voor het in bacteriën aanwezige Cas-enzym. Het Cas-enzym knipt vervolgens het virale genetische materiaal door, waardoor de bacterie wordt beschermd tegen virale infectie. Dit mechanisme komt van nature voor in bacteriën en wetenschappers hopen het in de toekomst te kunnen gebruiken voor het bewerken van gerichte genen om verschillende ziekten te behandelen.
In dit onderzoek gebruikten onderzoekers CRISPR/Cas9 voor het bewerken van het Δ32-allel in het CCR5-gen dat codeert voor CCR5-receptoren op CD4+-cellen (helper T-cellen). Hiv’s binden zich aan de CCR5-receptoren, waardoor ze CD4+-cellen binnendringen. Na binnenkomst maakt het HIV meerdere kopieën en vernietigt deze cellen, waardoor ze in aantal afnemen en uiteindelijk het immuunsysteem aantasten. Het belang van CCR5-receptoren bij de verspreiding van HIV-infectie werd aangetoond door een onderzoek dat in 1996 werd gepubliceerd. Hierin werd beweerd dat de Kaukasische deelnemers een mutatie in het CCR5-gen vertoonden die hen aanzienlijk resistent maakte tegen HIV-infectie. Deze Δ32-mutatie in het CCR5-gen werd minder vaak aangetroffen bij Afrikaanse en Aziatische deelnemers.
Voortbouwend op deze bevindingen infecteerden onderzoekers van de huidige studie gehumaniseerde muizen met HIV-1. Om te bevestigen dat de muizen geïnfecteerd zijn met HIV, testten de onderzoekers ze op viral load (hoeveelheid virus in het geïnfecteerde lichaam) en de afname van het aantal CD4+ T-cellen. Na een succesvolle infectie met HIV implementeerden ze een behandelingsroutine in 3 stappen, te beginnen met ART om de virale infectie te onderdrukken, gevolgd door AAV6 CRISPR/Cas9 (zie het einde van de alinea voor meer informatie) voor CCR5-genbewerking om de verspreiding van het virus te stoppen, en tot slot met AAV9 CRISPR/Cas9 om de LTR-Gag-regio van HIV te bewerken om provirale DNA-fragmenten te verwijderen. Onderzoekers pasten een combinatie van deze therapieën toe op zes groepen muizen. (Tabel-1)
AAV6 en AAV9 = Adeno Associated Virus type 6 en 9 zijn virale vectoren die worden gebruikt voor het toedienen van CRISPR/Cas9 gericht op respectievelijk het CCR5-gen en de LTR-Gag-regio.
Tabel-1: Samenvatting van de behandelingen gegeven aan elke muizengroep.
| GROUP NUMBER | TREATMENT GIVEN |
|---|---|
| GROUP-1 | No treatment |
| GROUP-2 | CRISPR-Cas9 targeting CCR5 and HIV-1 LTR Gag region |
| GROUP-3 | CAB, 3TC and ABC prodrugs, and RPV i.e ART |
| GROUP-4 | ART regimen + IV injection of AAV9-CRISPR-Cas9-targeting LTR-Gag |
| GROUP-5 | ART regimen + IV injection of AAV6-CRISPR-Cas9-targeting CCR5 |
| GROUP-6 | ART regimen + dual CRISPR (targeting CCR5 and HIV-1 LTR Gag) |
Resultaten
Na de behandeling werd elke groep muizen getest om de werkzaamheid van elke behandeling vast te stellen. In elke muizengroep werden tests uitgevoerd op de milt, het beenmerg, de darm, de hersenen, de lever en de longen.
Alle met ART behandelde groepen vertoonden verhoogde aantallen CD4+ T-cellen. De CD4+ niveaus waren matig in groep 4 en groep 5, terwijl groep 6 het hoogste aantal CD4+ cellen vertoonde. Het aantal CD4+ T-cellen was echter het laagst in groep 2.
DNA- en RNA-spiegels van HIV in muizengroepen werden ook geëvalueerd. Groep 6, die ART kreeg met dubbele CRISPR/Cas9-therapie, had geen viraal DNA in milt, darmen, beenmerg, longen, lever, nieren en hersenen.
Er werden verschillende andere analyses uitgevoerd om deze resultaten te valideren, zoals RNAscope, virale uitgroei-tests en druppelvormige digitale PCR. Bovendien observeerden de onderzoekers ook geen ART- of CRISPR-gerelateerde toxiciteiten door histologische (weefsel)analyses van milt-, lever- en nierweefsel.

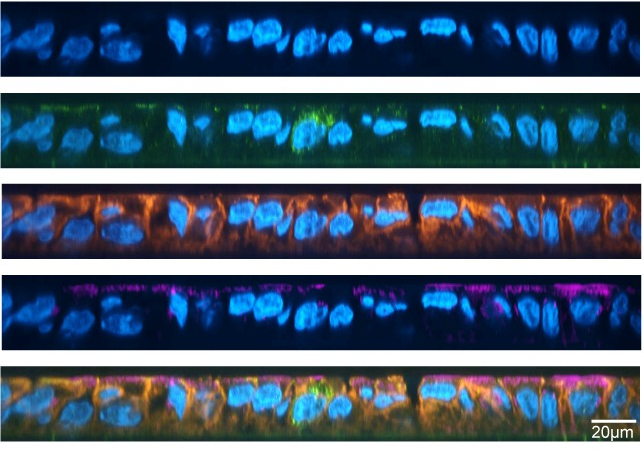
Tijdlijn van het onderzoek vanaf het genereren van gehumaniseerde muizen, hun infectie met HIV-1 gevolgd door behandelingen specifiek voor elke muizengroep. Grafieken tonen de resultaten van de waardering van menselijke CD45+, CD3+, CD4+ -T-cellen, virale belasting in elke groep na de behandeling en analyses die werden uitgevoerd op milt-, BM-, darm-, hersen-, lever- en longweefsel in elke muizengroep op de aanwezigheid van HIV-1 DNA. Bron– Originele artikel
Wat betekent het?
Dual CRISPR therapie liet significante verbeteringen zien in de genezingspercentages van HIV-1 in vergelijking met enkelvoudige behandelingen, wat duidt op een cruciale rol in het elimineren van de HIV-1 infectie.
Toch heeft deze behandelmethode zijn beperkingen. Het virusdragende systeem (AAV) is niet specifiek voor HIV, waardoor het sommige latente virusreservoirs in het lichaam kan missen. Het CRISPR-Cas systeem moet alle met HIV geïnfecteerde cellen bereiken, maar het is niet duidelijk hoe we ervoor kunnen zorgen dat dit gebeurt. Door de niet-specifieke targeting kan het zijn dat sommige latente HIV niet wordt verwijderd, wat leidt tot een rebound van het virus in sommige van de behandelde dieren.
Ondanks de beperkingen slaagde ART met dual CRISPR erin HIV-1 effectief te elimineren en heeft het potentieel voor klinische toepassing.
Vertaald door: Liang Hobma
Link to the original post:
CRISPR editing of CCR5 and HIV-1 facilitates viral elimination in antiretroviral drug-suppressed virus-infected humanized mice. 10.1073/pnas.2217887120 Dash, Prasanta K., et al. “CRISPR editing of CCR5 and HIV-1 facilitates viral elimination in antiretroviral drug-suppressed virus-infected humanized mice.” Proceedings of the National Academy of Sciences 120.19 (2023): e2217887120.
Featured image: Made by author with bioicons and canva
Other References-
Dash PK, Chen C, Kaminski R, et al. CRISPR editing of CCR5 and HIV-1 facilitates viral elimination in antiretroviral drug-suppressed virus-infected humanized mice. Proc Natl Acad Sci U S A. 2023;120(19):e2217887120. doi:10.1073/pnas.2217887120
Abdul A. Waheed and Eric O. Freed. HIV Type 1 Gag as a Target for Antiviral Therapy. AIDS Research and Human Retroviruses.Jan 2012.54-75.http://doi.org/10.1089/aid.2011.0230