Microbiologie in hapklare porties
Hoe beïnvloedt ziek worden de microben in je?
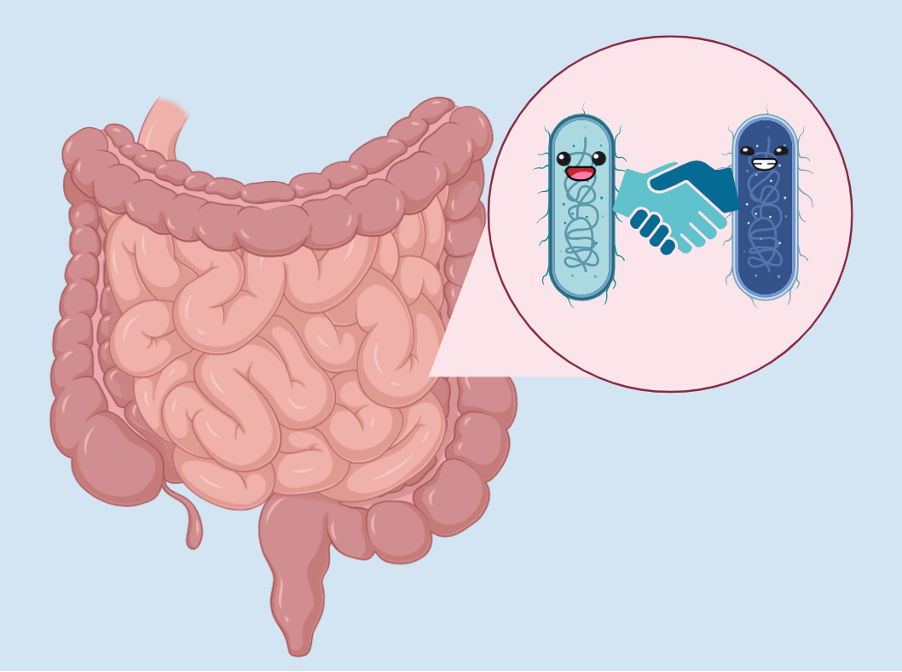
Duizenden andere levende soorten hebben hun thuis gevonden in verschillende delen van het menselijk lichaam. Eén zo’n hotspot in het menselijk lichaam is onze darm. Interessant genoeg zijn er meer niet-menselijke cellen in ons dan mensen. En dus hebben deze microben een enorme invloed op ons leven en onze gezondheid en worden ze op hun beurt ook beïnvloed door ons leven en onze gezondheid. Een groep wetenschappers van Yale wilde dus begrijpen hoe de microben die een thuis in ons hebben gevonden worden beïnvloed als we ziek worden.
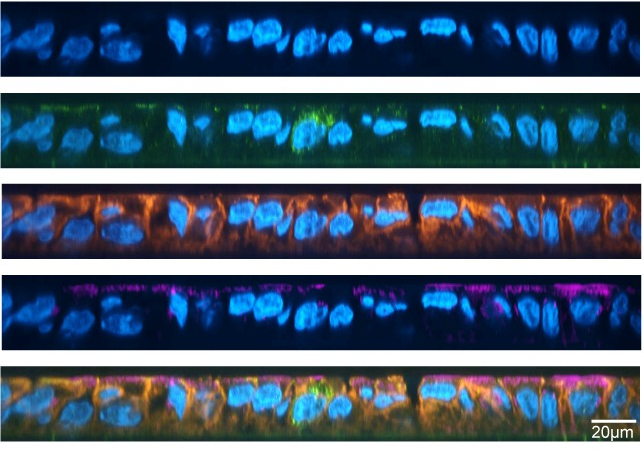
Ze gebruikten muizen als modelorganisme, in het bijzonder gnotobiotische muizen. Gnotobiotische muizen zijn muizen die in een steriele omgeving worden grootgebracht om alle micro-organismen uit te sluiten. Dus gnotobiotische muizen zouden geen eigen darmmicrobe hebben.
De onderzoekers introduceerden vervolgens kunstmatig verschillende stammen (genetisch verschillende lijnen) van de bacterie B. thetaiotamicron in gnotobiotische muizen en zagen dat de verschillende populaties stabiel waren onder normale omstandigheden (homeostase), maar veranderingen ondergaan wanneer ze geïnfecteerd worden met een pathogeen, dat wil zeggen een gevaarlijke microbe, C. rodentium. Wanneer ze geïnfecteerd worden met de bacterie, breiden sommige stammen zich selectief snel uit en domineren ze de B. thetaiotamicron populatie.
Net zoals iemand die naar een nieuw huis verhuist, zich aanpast aan zijn nieuwe buurt en zich aanpast aan zijn nieuwe woon-werkverkeer, doen microben hetzelfde in hun gastheren. Uit het onderzoek bleek dat B. thetaiotamicron-populaties zich aanpasten aan de darmen van de muizen en dat de aard van de aanpassing verschilde afhankelijk van of de muis gezond of geïnfecteerd was.
Bij verder onderzoek ontdekten ze dat een dominante stam in de geïnfecteerde muizen identieke enkelvoudige puntmutaties had. Puntmutatie verwijst naar een verandering van één enkel basenpaar in het genoom; het kan worden vergeleken met een verandering van één enkele noot in een muzikale compositie. Deze mutatie resulteerde in de productie van een veranderd eiwit, wat betekent dat het genoom informatie codeert die relevant is voor de eiwitproductie in de bacterie, waardoor deze beter kan groeien in de darmen van de geïnfecteerde muizen.
Wat is de rol van dit eiwit en hoe zorgt het ervoor dat de bacteriestam beter overleeft in de geïnfecteerde muizen? De functie van eiwitten wordt bepaald door de eiwitstructuur, dus gebruikten de auteurs computermiddelen om de structuur van het eiwit en het veranderde eiwit (met de enkelpuntmutatie) te voorspellen. Ze dachten dat het eiwit de productie van een enzym genaamd thiolperoxidase zou kunnen reguleren. Enzymen zijn eiwitten met katalytische activiteit. Dit enzym speelde met name een beschermende rol in de verdediging tegen oxidatieve stress, stress die wordt veroorzaakt door de verhoogde aanwezigheid van reactive oxygen species (ROS), wat extreem instabiele moleculen zijn die zuurstof bevatten en die gemakkelijk reageren met verschillende andere moleculen in een cel.
Dus hoe houdt het allemaal verband met elkaar? De geïnfecteerde muizen zijn gestrest en een van de vele verdedigingsstrategieën van immuuncellen in het lichaam is het vrijgeven van ROS. Nu lopen alle microben in de darm een verhoogd risico om te sterven doordat deze onstabiele zuurstofhoudende moleculen reageren met verschillende moleculen die nodig zijn voor het normaal functioneren van de bacteriën. De bacteriestammen met de enkelvoudige puntmutatie zouden een verhoogde bescherming hebben tegen ROS, waardoor ze beter overleven en de populaties domineren. Het voordeel dat deze stammen bieden, geldt alleen als ze groeien in een omgeving met hoge niveaus van ROS. Met andere woorden, voor niet-geïnfecteerde muizen zijn deze stammen niet speciaal omdat ze geen voordeel bieden. Daarom zijn hun niveaus in de populaties veel lager en zelfs afwezig. De uitbreiding van de gemuteerde bacteriën is een strategie die B. thetaiotamicron gebruikt om te reageren en te overleven in hun aangepaste thuis (een ontstoken darm).
De auteurs wilden zien of hun observaties met het muizen-modelsysteem ook voor mensen zouden gelden. Ze onderzochten de microben die aanwezig waren bij mensen uit twee groepen: met inflammatoire darmziekten en gezonde controles. De auteurs zagen dat, hoewel de gemuteerde bacteriën aanwezig waren, ze niet uniform aanwezig waren en verschilden tussen individuen en in de tijd. Het oorspronkelijke muismodel was simplistisch: B. thetaiotamicron was de enige microbe naast de ziekteverwekker. In werkelijkheid heeft de menselijke darm veel meer microben. Hoewel we eerder hebben besproken hoe de gastheer de microbe beïnvloedt en vice versa, is er nog een derde dimensie van interacties. Dit is de interactie tussen de microben zelf. Er werd ontdekt dat vitamine B6 werd gebruikt door de microben in deze interacties. Gebaseerd op andere aanwezige microben, evolueerde de B. thetaiotamicron populatie in de geïnfecteerde muizen en ontstond de gemuteerde stam. In sommige gevallen remde de aanwezigheid van andere microben de uitbreiding van de gemuteerde stam in de geïnfecteerde muizen. Dit verklaart de eerdere waarneming met menselijke monsters.
Dit onderzoek laat zien hoe de microben in het lichaam reageren op signalen van de gastheeromgeving en op signalen van elkaar. De microben ondergaan dynamische veranderingen in reactie op verschillende signalen. Deze dynamische veranderingen kunnen worden gebruikt als een handtekening voor de detectie van menselijke ziekten of kunnen worden aangepast om het gastheerorganisme te helpen infecties af te weren.
Featured image: Credit: CC0 Public DomainLink: https://scx1.b-cdn.net/csz/news/800a/2017/gutbacteria.png
Vertaald door: Liang Hobma