Microbiologie in hapklare porties
Vax the bats! Kan vleermuisherpes de verspreiding van hondsdolheid tegengaan?
Dankzij wereldwijde vaccinatiecampagnes is het gelukt om een aantal van ‘s werelds meest kwaadaardige virussen te temmen. De sleutel tot het verminderen van uitbraken is voorkomen dat virussen zich gemakkelijk verspreiden. Volksgezondheidsmaatregelen zoals sociale afstand, betere sanitaire voorzieningen en het dragen van maskers zijn goede manieren om de overdracht te verminderen, maar vaccinatie blijft het meest effectief omdat het de route van overdracht blokkeert. Zonder het vermogen om zich te verspreiden, kunnen virussen zich niet vermenigvuldigen en neemt het aantal besmettelijke virusdeeltjes af. Deze strategie leidde tot de uitroeiing van de ziekte. Deze strategie leidde tot de uitroeiing van de pokken en wordt tegenwoordig gebruikt om de last van veel verschillende virusziekten te verminderen. Maar zelfs de beste verdediging heeft zwakke punten. Wilde dieren die drager zijn van virussen zijn moeilijk te vaccineren en kunnen de ziekte op mensen overbrengen. In een recente studie onderzochten onderzoekers een nieuw type vaccin dat mogelijk virussen in wilde populaties kan elimineren.
Hondsdolheid is een beruchte ziekte die wordt veroorzaakt door virussen van het geslacht Lyssavirus. Deze virussen infecteren het zenuwstelsel en veroorzaken ongewone symptomen zoals verwardheid, spierkrampen en zelfs watervrees. Dieren die besmet zijn met hondsdolheid worden ziekelijk en agressief, waardoor ze andere dieren en soms mensen bijten en de ziekte verspreiden. Zodra de symptomen verschijnen, is hondsdolheid bijna altijd dodelijk. Het voorkomen van overdracht van het virus is cruciaal, maar niet eenvoudig. In tegenstelling tot andere virussen heeft rabiës een groot gastheerbereik en kan het de meeste warmbloedige zoogdieren infecteren. Sommige van deze dieren zijn moeilijk te vaccineren, waardoor ze vatbaar zijn voor infectie. Als er geen beperkingen zijn, kan een virus zich verspreiden en vermenigvuldigen binnen een dierenpopulatie, waardoor er een virusreservoir ontstaat dat elk moment kan overslaan op mensen. Zonder een manier om virale reservoirs te beheren, zullen uitbraken van hondsdolheid bij mensen een probleem blijven.
In Latijns-Amerika zijn vampiervleermuizen een reservoir voor het rabiësvirus en de oorzaak van recente uitbraken bij mensen. Zoals hun naam al zegt, is bloed de belangrijkste voedselbron van vampiervleermuizen. Vampiervleermuizen hebben vlijmscherpe tanden en stoffen in hun speeksel die de bloedstolling van hun prooi tegengaan. Deze eigenschappen maken het ook makkelijk voor vampiervleermuizen om hondsdolheid over te brengen op andere vleermuizen en dieren. Door de menselijke vernietiging van hun natuurlijke habitat neemt de activiteit van vampiervleermuizen in landbouwgebieden toe en is vee hun favoriete voedselbron geworden. Een weiland met koeien kan al snel een vleermuizenbuffet worden en een broedplaats voor overvliegende dieren.
De huidige manier om door vampiervleermuizen overgebrachte hondsdolheid onder controle te krijgen is door vleermuispopulaties te doden met gif, wat zowel inhumaan als ineffectief is. Het ruimen zorgt ervoor dat vleermuizen naar nieuwe locaties vluchten, waardoor het virus zich nog meer verspreidt.
Pogingen om een praktisch vaccin voor vleermuizen te ontwikkelen zijn mislukt. Huisdieren zijn relatief eenvoudig te vaccineren door middel van injecties. Als je een hond of kat hebt, breng je ze waarschijnlijk om de paar jaar naar de dierenarts voor een rabiësinjectie. Routinevaccinatie zorgt ervoor dat je harige vriend beschermd blijft tegen hondsdolheid, terwijl je zelf minder risico loopt om het virus op te lopen. Vaccinatie van huisdieren is zo succesvol dat rabiës die door honden wordt overgedragen bijna is uitgeroeid in Amerika. Het vaccineren van wilde dieren is iets lastiger, maar het is mogelijk. Voor carnivoren (zoals wasberen, stinkdieren en vossen) wordt aas verspreid in hun bekende leefgebieden om de vaccins oraal toe te dienen. Geen van beide vaccinatiestrategieën werkt echter voor vleermuizen. Vleermuizen rusten op afgelegen locaties die moeilijk te bereiken zijn, waardoor het moeilijk is om er veel te vangen om een vaccin toe te dienen. Omdat vampiervleermuizen alleen vers bloed drinken, is het gebruik van lokaas om een oraal vaccin toe te dienen geen optie. Gelukkig bieden overdraagbare vaccins een oplossing.

De biologie heeft het rabiësvirus misschien een manier gegeven om de huidige vaccinatiestrategieën te omzeilen, maar het heeft ook een potentiële oplossing geboden. Met enkele aanpassingen worden virussen al een tijdje gebruikt om vaccins te maken. Levende vaccins worden gemaakt door een pathogeen virus zodanig te verzwakken dat het niet langer ernstige ziekteverschijnselen veroorzaakt, maar nog wel een immuunrespons opwekt. In hun verzwakte staat kunnen de virussen in een levend vaccin zich niet vermenigvuldigen en verspreiden naar anderen. Sommige virussen zijn van nature niet pathogeen en kunnen hun gastheer infecteren met milde of geen symptomen. Overdraagbare vaccins zijn een technologie in ontwikkeling die deze virussen in ons voordeel gebruikt.
Deze virussen zouden worden gebruikt om een overdraagbaar vaccin te maken door bio-engineering van het niet-pathogene virus om een eiwit van een ander virus tot expressie te brengen. Dit zal een immuunrespons opwekken tegen het pathogene virus zonder ziektesymptomen te veroorzaken. Nog belangrijker is dat een overdraagbaar vaccin kan worden doorgegeven tussen individuen, waardoor het gemakkelijker en goedkoper wordt om kudde-immuniteit te bereiken in een populatie. Ondanks de potentiële voordelen worden overdraagbare vaccins nog lang niet gebruikt; er is meer onderzoek nodig om ervoor te zorgen dat ze veilig en efficiënt worden toegepast. Recente bevindingen van een onderzoeksteam in Glasgow hebben de wereld een stap dichter gebracht bij het gebruik van overdraagbare vaccins om het hondsdolheidsvirus te bestrijden.
Desmodus rotundus betaherpesvirus (DrBHV) is een niet-pathogeen herpesvirus dat alleen vampiervleermuizen en nauw verwante vleermuissoorten kan infecteren. Onderzoekers zagen in dat DrBHV gebruikt zou kunnen worden om een overdraagbaar vaccin voor vleermuizen te maken, maar ze moesten uitzoeken hoe effectief het zou zijn. Om dit te doen, maakten ze eerst statistische modellen met behulp van sequentiegegevens van speekselmonsters van vleermuizen om de transmissiedynamiek van DrBHV te bepalen. Daarna konden ze schatten hoe het overdraagbare vaccin uitbraken van hondsdolheid zou beïnvloeden. Uit hun simulaties toonden de onderzoekers aan dat het vaccineren van één enkele vampiervleermuis meer dan 80% van een vleermuispopulatie zou kunnen immuniseren, waardoor kuddeimmuniteit tegen hondsdolheid wordt bereikt. Ze ontdekten ook dat DrBHV lijkt op andere herpesvirussen en een levenslange infectie kan veroorzaken waarbij het virus heen en weer gaat tussen een slapende en actieve toestand. Dit suggereert dat een vaccin dat gebruik maakt van DrBHV niet alleen overdraagbaar zou zijn op andere vleermuizen, maar ook “zelfversterkend” zou kunnen zijn omdat een slapend virus dat reactiveert ook de immuunrespons tegen hondsdolheid zou versterken. Een overdraagbaar vaccin gemaakt met DrBHV heeft het potentieel om uitbraken van hondsdolheid met 50 tot 95% te verminderen en zou de gevolgen van de ziekte voor de menselijke gezondheid aanzienlijk verminderen. Dit onderzoek biedt niet alleen een oplossing voor het bestrijden van virale reservoirs, maar legt ook de basis voor het ontwikkelen van andere veilige en effectieve overdraagbare vaccins.
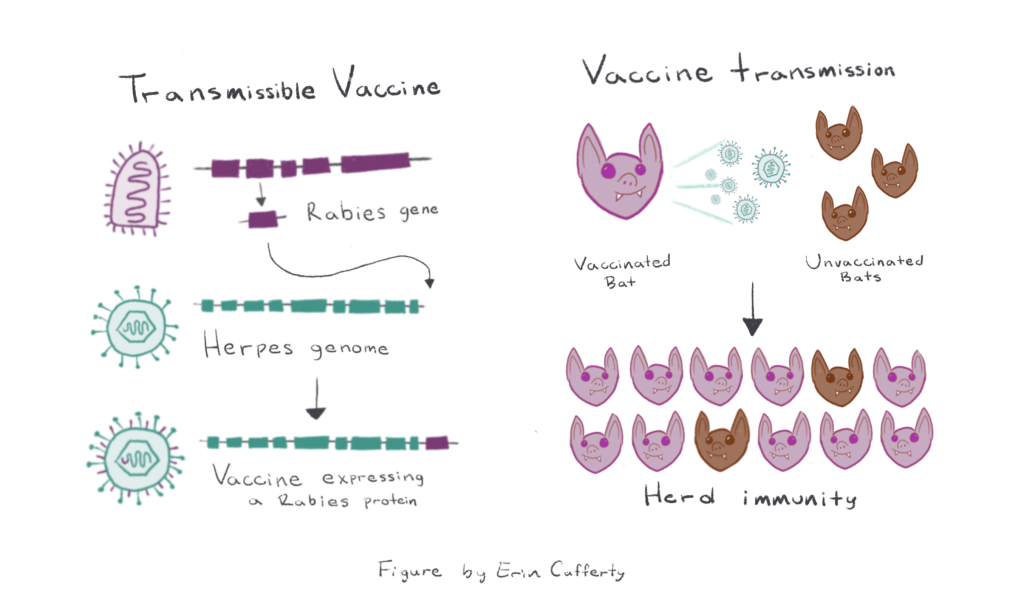
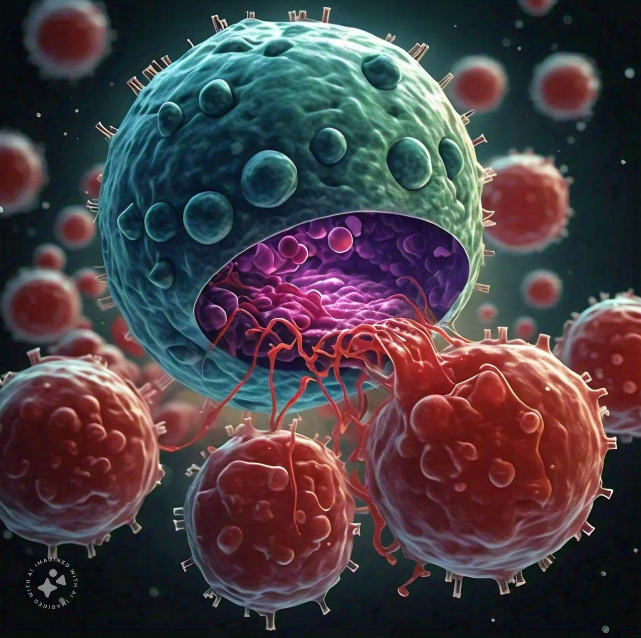
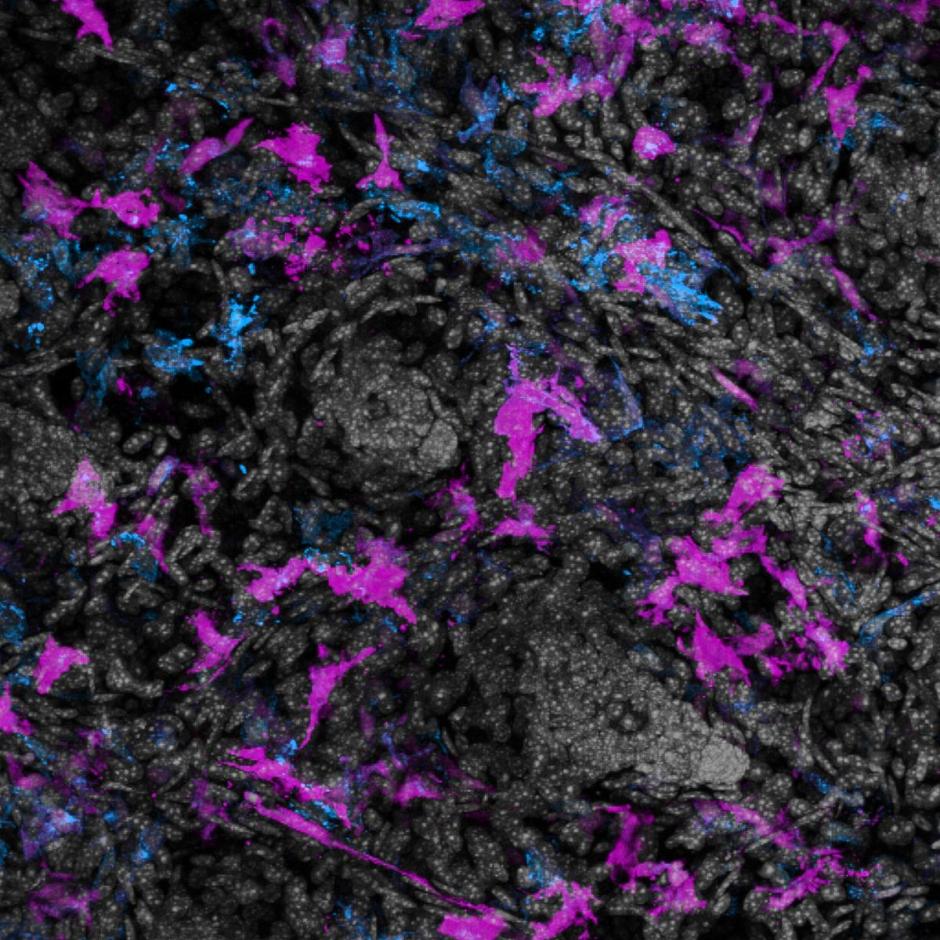
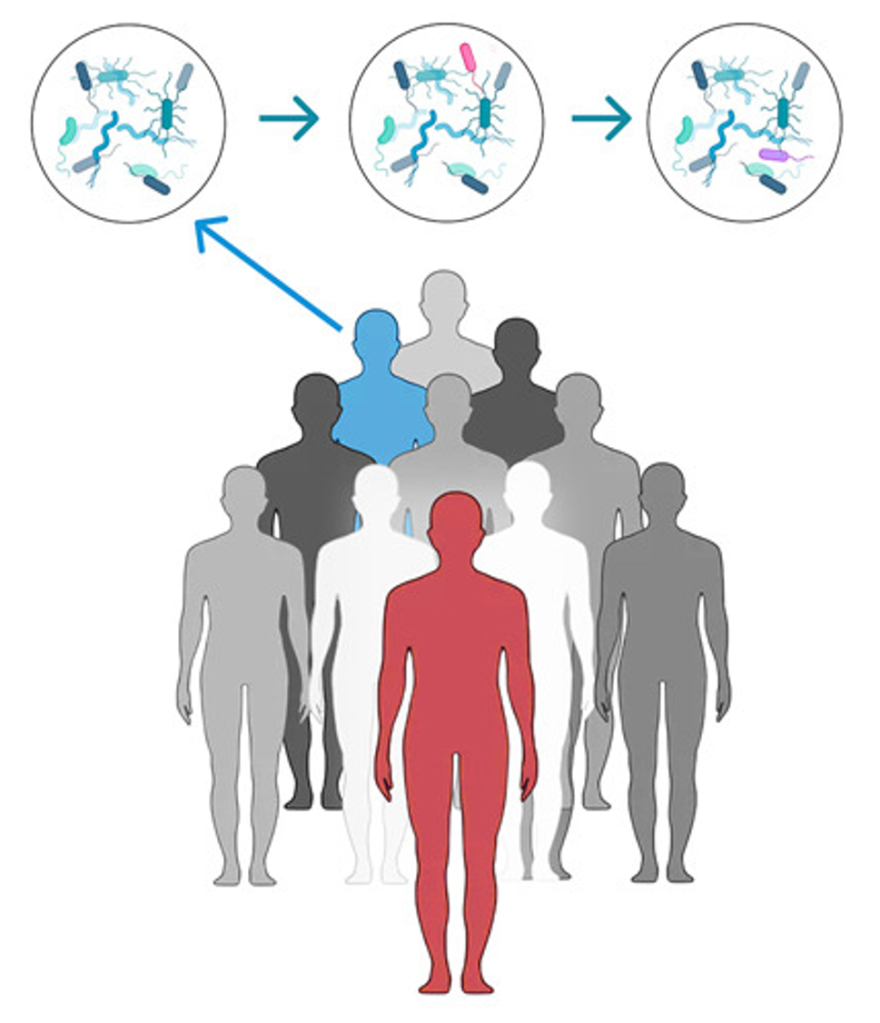
Dit resulteert in het niet-pathogene Herpesvirus dat een Rabiës-eiwit tot expressie brengt, dat wordt gebruikt als overdraagbaar vaccin (weergegeven in groenblauw en paars).
Rechts: Een vleermuis gevaccineerd met het overdraagbare vaccin is weergegeven in paars
Een gevaccineerde vleermuis (weergegeven in paars) verspreidt het vaccinvirus naar niet-gevaccineerde vleermuizen (weergegeven in bruin). Na verloop van tijd kan dit leiden tot kudde-immuniteit, waarbij de meeste vleermuizen in een populatie immuun zijn voor het rabiësvirus.
Additional sources:
Epidemiology and biology of a herpesvirus in rabies endemic vampire bat populations
Previous research from same authors, https://www.nature.com/articles/s41467-020-19832-4
Featured image: Made by the author
Vertaald door: Liang Hobma