Microbiologie in hapklare porties
Kanker veroorzakende bacteriën
In een rapport van het National Cancer Institute uit 2020 wordt geschat dat er in de Verenigde Staten jaarlijks 1,8 miljoen gevallen van kanker en 600.000 sterfgevallen zullen zijn. Wanneer wetenschappers het hebben over carcinogenen, of kankerverwekkende stoffen, komen er een paar veelvoorkomende naar voren. Enkele algemeen bekende kankerverwekkende stoffen zijn het roken van tabak, alcohol en ultraviolet licht van de zon.
Veel mensen denken echter niet vaak aan bacteriën als potentiële kankerverwekkers. Dit komt vooral omdat bacteriën vaak acute, korte infecties veroorzaken die vrij snel worden genezen door antibiotica en het immuunsysteem. Sommige bacteriële infecties kunnen echter langdurige gevolgen hebben voor het immuunsysteem van de gastheer, zoals de ontwikkeling van kanker.
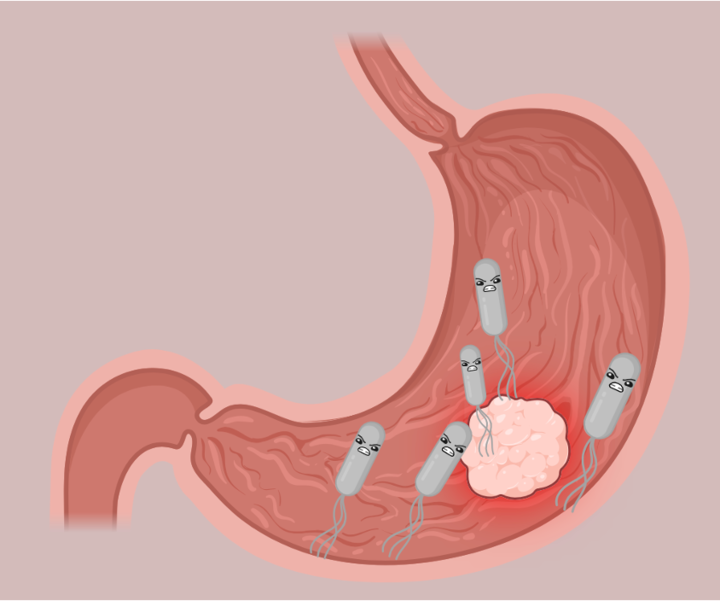
De meest voorkomende bacterie die in verband wordt gebracht met kanker is de maag ziekteverwekker Helicobacter pylori, die sinds 1994 is geclassificeerd als kankerverwekkend. Ondanks de correlatie tussen H. pylori en maagkanker, wordt niet volledig begrepen hoe deze relatie werkt. Sommige onderzoeken suggereren dat H. pylori kanker bevordert door langdurige ontsteking, waardoor de kans toeneemt dat iemand kanker ontwikkelt. De auteurs van dit artikel vroegen zich echter af of specifieke kenmerken van de H. pylori-stammen zelf kanker meer zouden kunnen bevorderen dan andere stammen.
Op zoek naar mutaties bij de bron
Om mutaties in H. pylori-stammen te identificeren die mogelijk maagkanker bevorderen, maakten de onderzoekers in dit onderzoek gebruik van een uitgebreide verzameling van gesequencede klinische isolaten van H. pylori van over de hele wereld.
Bij het bekijken van de DNA-sequenties van deze stammen ontdekten de auteurs dat één bepaalde mutatie in een bacterieel protease genaamd hoge temperatuur vereiste A (HtrA) extreem vaak voorkwam in H. pylori-stammen geïsoleerd van patiënten met ernstige vormen van maagkanker.
Interessant genoeg was deze mutatie een single nucleotide polymorfisme (SNP), waarbij een enkele nucleotide in een gen wordt veranderd. Meestal heeft een SNP niet zo vaak invloed op de algehele eiwitsequentie van een gen. Dit komt omdat de codons die elk aminozuur coderen vaak meerdere variaties hebben.
De enkele nucleotide verandering die hier werd geïdentificeerd was echter significant, omdat het resulteerde in een aminozuurverandering in het 171ste aminozuur van het eiwit. Omdat in het algemeen de volgorde van eiwitten belangrijk is voor de structuur en functie, waren de auteurs benieuwd of dit deel van de eiwitsequentie belangrijk was voor de functie.
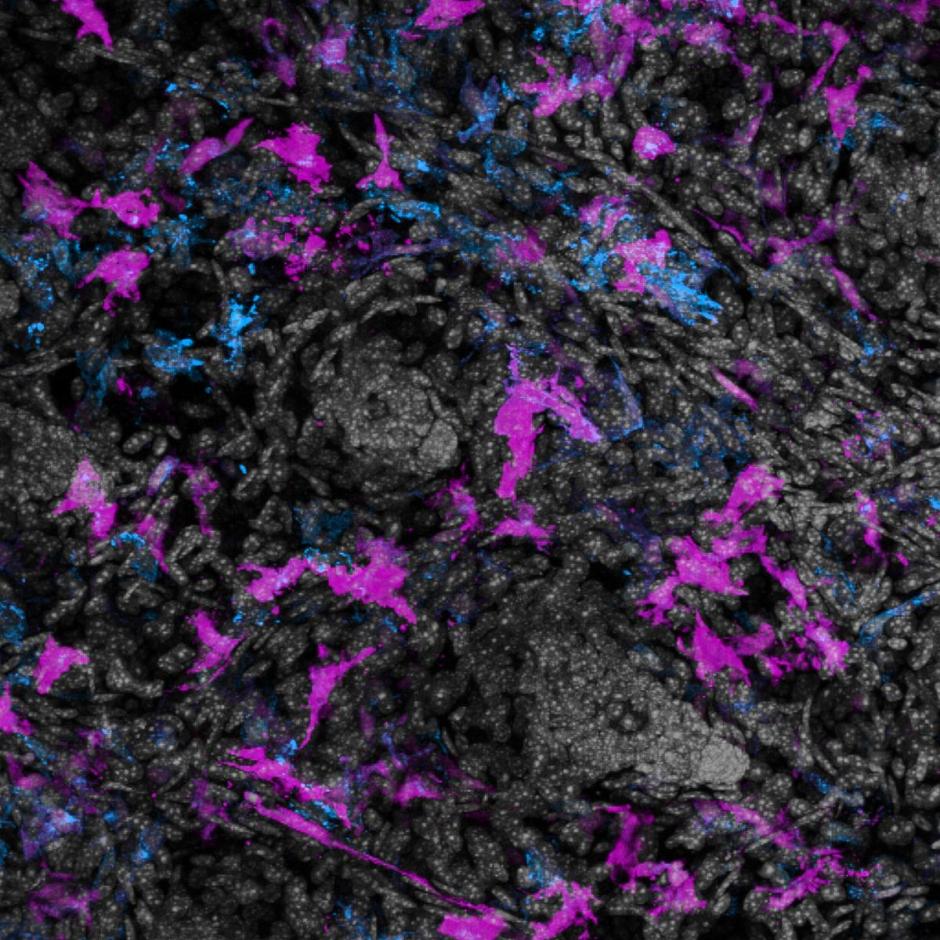
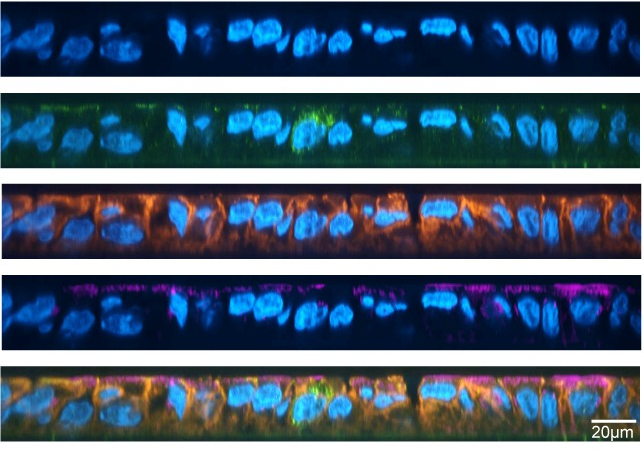
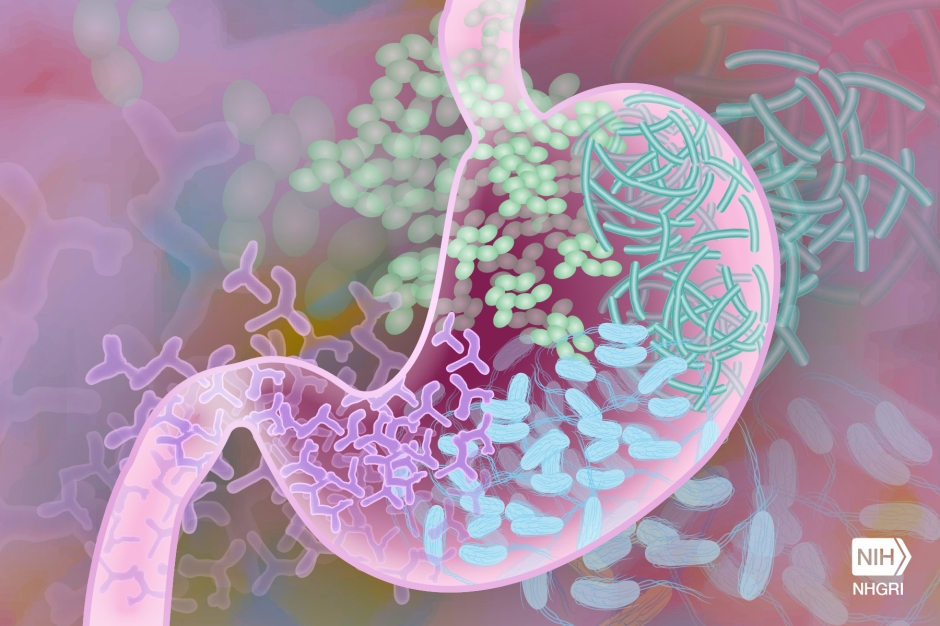
Het aminozuur bevond zich inderdaad in een gebied van HtrA dat verantwoordelijk is voor zijn activiteit – het proteasedomein. Proteasen worden vaak geïdentificeerd als virulentiefactoren van ziekteverwekkers, omdat hun functie bestaat uit het afbreken van eiwitten, waaronder eiwitten die belangrijk zijn voor de gastheer. Dit is vooral het geval met HtrA, waarvan bekend is dat het de tight junctions in maagcellen afbreekt (figuur 1). Door deze splitsing kan H. pylori zich tussen de maagcellen wringen naar een gebied ver weg van het maagzuur, dat te zuur is voor bacteriën om te groeien. Eenmaal in een gunstige omgeving kan H. pylori zijn energie richten op het injecteren van gifstoffen in de maagcellen, die de immuunrespons activeren en uiteindelijk de ontwikkeling van kanker bevorderen.
Wat doet deze mutatie?
Nu deze mutatie was geïdentificeerd, vroegen de auteurs zich af of deze mutatie daadwerkelijk invloed had op de activiteit van HtrA, of dat deze mutatie toevallig veel voorkomt in H. pylori-stammen die maagkanker veroorzaken.
Om dit te onderzoeken keken de auteurs eerst naar de protease activiteit tussen de maagkankerstammen en de stammen van niet-kankerpatiënten. Toen ze de twee vergeleken, ontdekten ze dat stammen met de 171L HtrA-mutatie (aminozuur 171 als een leucine) meer protease activiteit hadden dan stammen zonder de HtrA-mutatie (aminozuur 171 als een serine). Bovendien vonden ze dat de H. pylori-stammen voor maagkanker de tight junctions van maagcellen meer afbreken dan de niet-kanker H. pylori-stammen. Dit was significant bewijs voor de auteurs dat de 171L HtrA mutatie, die werd waargenomen in klinische isolaten van H. pylori van maagkankerpatiënten, de degradatie van de tight junctions en de algehele kankerprogressie bevorderde.
Vervolgens wilden de auteurs zien of de 171L variant van HtrA specifiek in staat was om tight junction eiwitten af te breken. Hiervoor gebruikten ze fluorescentiemicroscopie om de tight junctions te visualiseren in 171L varianten van HtrA versus 171S varianten van HtrA. Ze zagen inderdaad dat de niveaus van occludine, een specifiek eiwit dat de sterkte van tight junctions in stand houdt, verlaagd waren in de 171L HtrA-varianten vergeleken met de 171S-varianten. Dit gaf de auteurs veel bewijs om te concluderen dat de HtrA 171L variant de tight junctions in maagcellen afbrak (afbeelding 1).
Het in verband brengen van de bacteriemutatie met kanker:
Nu de auteurs wisten dat de 171L variant van HtrA een hogere protease activiteit had, wilden ze bepalen of deze variant resulteerde in andere kanker-gerelateerde fenotypes. Eerst onderzochten ze het vermogen van de klinische isolaten van H. pylori om chronische ontsteking te induceren. Stammen met de 171L variant van HtrA hadden hogere niveaus van verschillende activatoren van de immuunrespons, met name van het ontstekingsbevorderende cytokine interleukine-8.
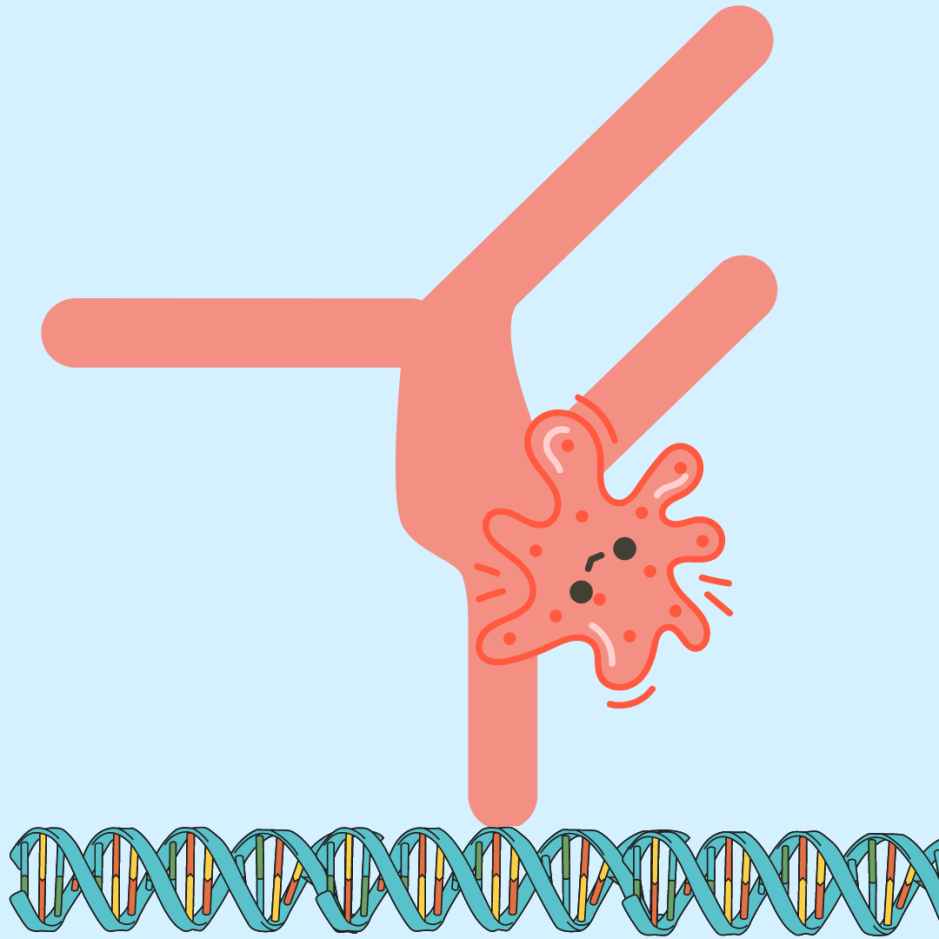
Bovendien onderzochten de auteurs ook het vermogen van deze stammen om DNA-breuken in de gastheercellen te induceren. DNA-beschadiging wordt vaak in verband gebracht met kanker, omdat dubbelstrengs DNA-breuken vaak tot nog meer mutaties kunnen leiden omdat gastheereiwitten die de breuken herstellen, de volgorde van het DNA niet altijd perfect herstellen. Zoals ze voorspelden, veroorzaakten de stammen van H. pylori met de 171L HtrA-variant aanzienlijke DNA-schade bij de gastheer (figuur 2). Deze experimenten gaven de auteurs nog meer bewijs dat de 171L variant van HtrA kanker bevordert.
Hoe gaan we nu verder?
De bevindingen van dit artikel legden een direct verband tussen een enkele mutatie in HtrA op aminozuur 171 en de ontwikkeling van maagkanker. Stammen met deze mutatie hadden grote invloed op de functie van dit eiwit. Belangrijk voor de progressie van kanker is dat deze mutatie meer degradatie van tight junctions en chronische ontsteking veroorzaakte in vergelijking met stammen die deze mutatie niet hadden. Bovendien veroorzaakten H. pylori-stammen met deze mutatie een toename in dubbelstrengs DNA-breuken, wat een belangrijke indicator is voor de ontwikkeling van kanker. Al met al zijn er meer onderzoeken nodig om te bepalen of het hebben van een stam met deze mutatie op de lange termijn een grotere kans op kanker geeft. Deze onderzoeken zijn echter een goede opstap naar de lange reis die het kankeronderzoek nog voor de boeg heeft.
Featured image: Made by author with BioRender.
Vertaald door: Liang Hobma