De la microbiologie pour ceux qui ont les crocs
Les bactéries manipulent nos cellules grâce à la physique
par Audrey Laurent Granger
Les bactéries sont partout, y compris à l’intérieur de nous. Le microbiote intestinal, bien connu, en est rempli. Mais si certaines bactéries se retrouvent là où elles ne devraient pas et échappent au système immunitaire, elles peuvent causer des maladies allant d’une simple infection urinaire à des cas graves comme une méningite. Le méningocoque, notamment, peut quitter la gorge où il est inoffensif et entrer dans la circulation sanguine. Ce qui change tout ? Sa capacité à s’accrocher aux parois des vaisseaux sanguins et à les déformer : sans cet ancrage, il serait éliminé sans causer de dégâts. Tout repose sur cette étape alors forcément, ça donne envie d’y regarder de plus près… C’est ce qu’ont fait Audrey Laurent Granger, Kévin Sollier et leurs collaborateur·rices dans leur article publié par Nature Communications en novembre 2025. Commençons par quelques révisions de notions clés !
C’est quoi la membrane cellulaire déjà ?
Le corps humain, comme tout être vivant, est constitué de cellules qui coopèrent pour remplir des fonctions précises, comme les cellules endothéliales qui forment la paroi des vaisseaux sanguins. Chaque cellule est entourée d’une membrane plasmique, contient un noyau avec de l’ADN, et un cytoplasme riche en organelles et molécules diverses. La membrane, faite d’une bicouche de lipides et de protéines, sépare l’intérieur de la cellule de l’extérieur. Certaines protéines qui s’y trouvent sont nommées « récepteurs » car elles permettent à d’autres molécules de s’y accrocher – donc de les « recevoir ». La membrane permet à la cellule de percevoir son environnement, s’attacher à des surfaces ou d’autres cellules, et échanger avec elles. Pour faciliter tout ça, la membrane peut se déformer en structures larges ou fines pour s’étendre, ou en tube pour communiquer avec les cellules voisines.
Sur le fil… d’une bactérie
Certaines bactéries comme le méningocoque sont recouvertes de filaments collants et mobiles appelés pili de type 4 (PT4). Lorsque le méningocoque s’ancre à la membrane plasmique des cellules endothéliales, il utilise ses fibres très fines, pour trouver ses récepteurs et s’ancrer.
Et la capillarité dans tout ça ?
La capillarité, c’est par exemple l’eau qui est « aspirée » dans une éponge sans l’aide de la gravité. Ici, on parle plutôt de mouillage qui décrit la capacité d’un liquide à s’étaler sur une surface à laquelle il colle, mais les deux phénomènes sont liés. Etonnamment, la membrane cellulaire est comparable à un liquide grâce à sa composition lipidique et sa malléabilité. Sa composition se modifie localement lorsqu’elle se déforme, en éloignant ou accumulant certaines molécules en fonction de leur forme.
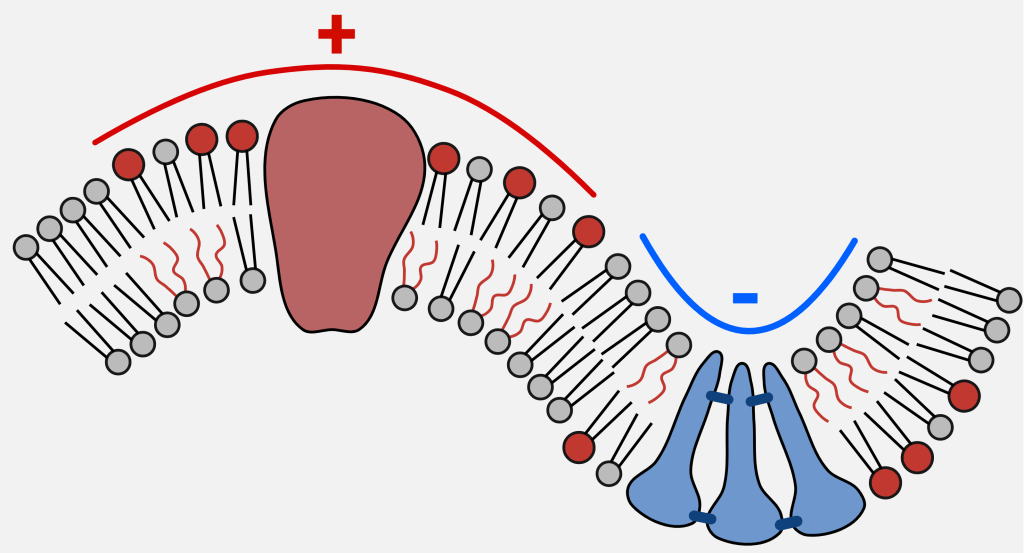
© HAL Id : tel-05351463
Lorsque le méningocoque s’ancre aux cellules des vaisseaux sanguins, on observe au microscope que la membrane de ces cellules se déforme en « tubes » allongés autour des bactéries. Habituellement, les déformations membranaires sont soutenues par le squelette interne de la cellule (l’actine) et se produisent grâce à la coordination de multiples facteurs chimiques. Or, lors de l’ancrage du méningocoque, ces déformations apparaissent dans toutes sortes de conditions inhabituelles ! Elles se forment même si l’actine est retirée. Plus étonnant encore, elles apparaissent également dans des cellules mortes (fixées chimiquement), et même dans de simples fragments de membrane (des “PM-sheets”, fabriqués à partir de cellules mortes par sonication). L’apparition de déformations membranaires causée par les bactéries se produit donc en premier et n’a pas besoin de réaction chimique de la part de la cellule.
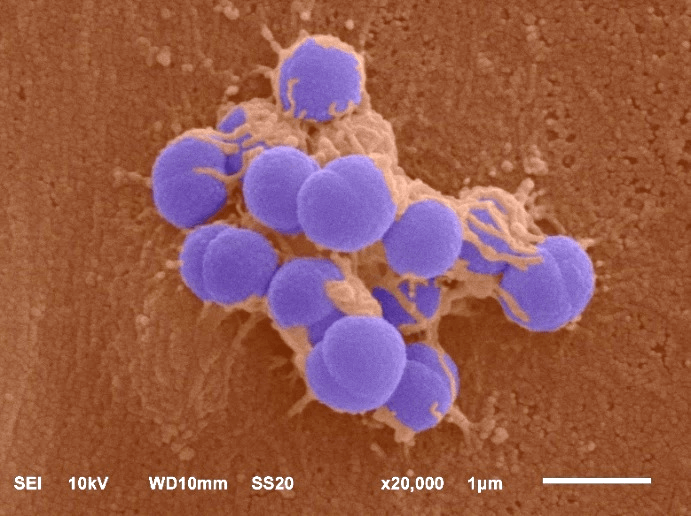
Membrane cellulaire en orange et méningocoque en violet. La membrane est déformée au contact des bactéries.
© Audrey Laurent Granger
Pour expliquer ce phénomène, le modèle – proposé dès 2018 par A. Charles-Soyer et collaborateur·rices – est que ces déformations apparaissent par mouillage de la membrane cellulaire le long des filaments adhésifs bactériens (les PT4), et relèvent donc d’un phénomène purement physique. En 2025, A. Laurent Granger et ses collaborateur·rices vont encore plus loin et se concentrent sur le comportement des récepteurs de la membrane cellulaire.
Leur hypothèse ? Les déformations de la membrane, qui apparaissent au contact de la bactérie, faciliteraient la rencontre avec le bon récepteur et permettraient ainsi à la bactérie de s’ancrer à la cellule.
Pour tester cette idée, les chercheur·euses utilisent la microscopie dite « corrélative » : on superpose = corrèle une image de microscopie à fluorescence (qui met en évidence la localisation des protéines de la membrane) avec une image de microscopie électronique (qui montre la forme de la structure 3D en surface des cellules). Cette technique permet de démontrer que certaines protéines de la membrane cellulaire – appelées CD9 – s’accumulent spécifiquement dans les déformations membranaires causées par le méningocoque sur des cellules normales, fixées (et donc mortes) et sur des PM-sheets.
Mieux encore, l’étude des déplacements de CD9 montre qu’il se comporte comme les récepteurs membranaires nécessaires à l’ancrage du méningocoque. Les chercheur·euses concluent alors que ces récepteurs – comme CD9 – s’accumulent dans les déformations membranaires dès le premier contact du méningocoque. Ainsi, la bactérie augmente considérablement ses chances de trouver ses récepteurs, et donc de s’ancrer à la cellule et ensuite causer des dégâts dans tout l’organisme.
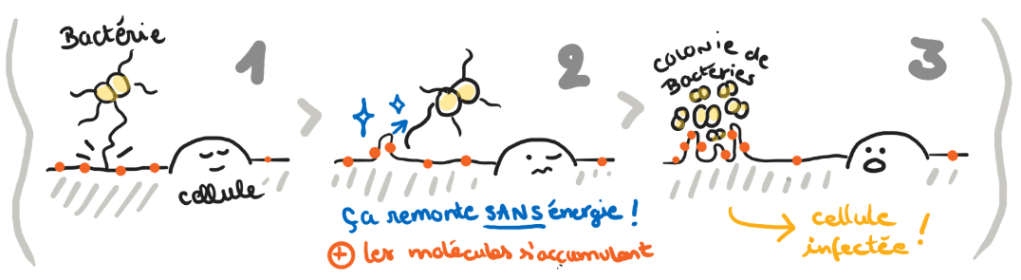
Cette découverte montre qu’un simple contact physique peut suffire à déformer une cellule et à accumuler localement des récepteurs : un nouvel angle pour comprendre les infections bactériennes et les interactions cellulaires !
Article original: Laurent-Granger, A., Sollier, K., Saubamea, B. et al. Meningococci drive host membrane tubulation to recruit their signaling receptors. Nat Commun 16, 10433 (2025). https://doi.org/10.1038/s41467-025-65436-1
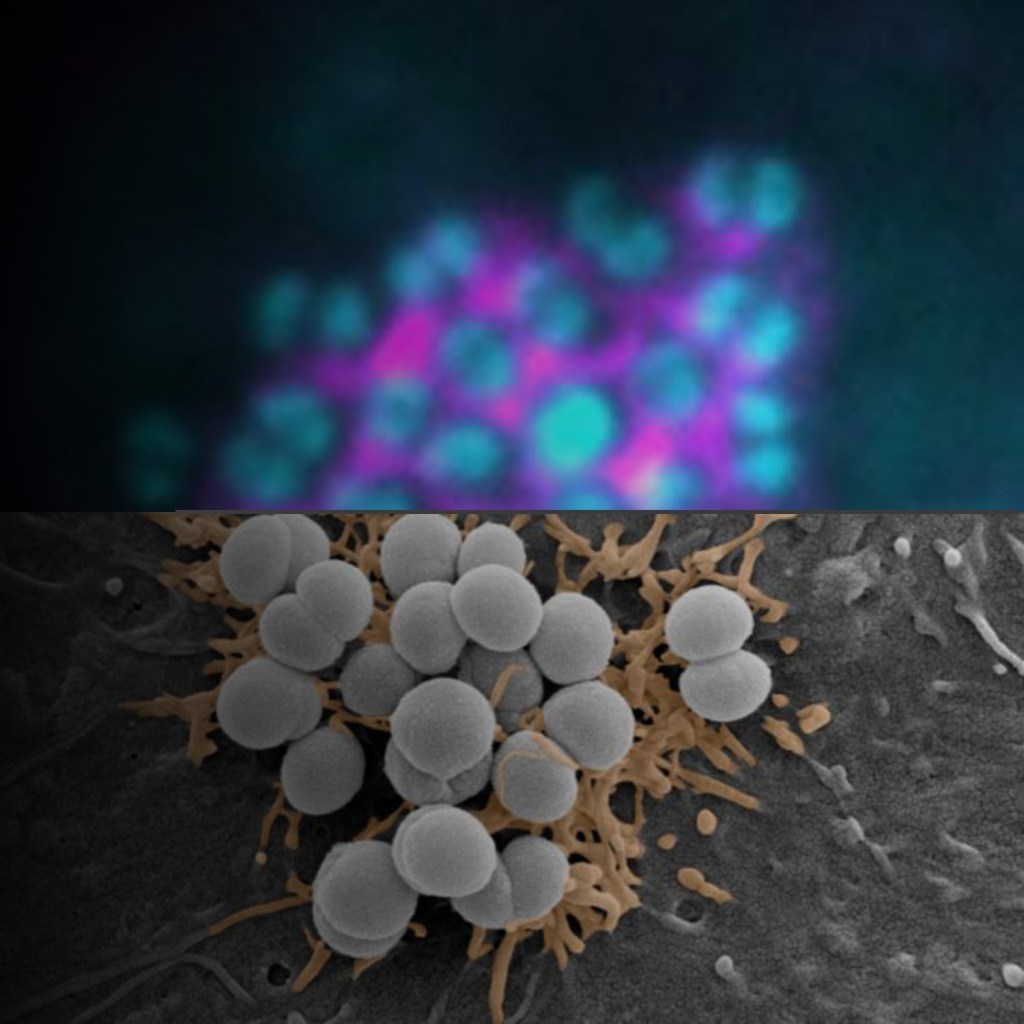
Image: Cellule endothéliale infectée par une colonie de méningocoques.
Microscopie à immunofluorescence (haut ; bactéries en cyan et protéine cellulaire en magenta) et microscopie électronique à balayage colorée numériquement (bas ; déformations membranaires en orange).
© Audrey Laurent Granger