Microbiologie in hapklare porties
Het verhaal van bacteriële opoffering
De boom van het leven verbindt alle levende organismen op aarde, waaronder dieren, planten, bacteriën en schimmels. Hoewel deze organismen sterk van elkaar verschillen, hebben ze ten minste één ding gemeen: ze worden allemaal geïnfecteerd door micro-organismen. Als gevolg daarvan hebben ze strategieën ontwikkeld om hun indringers te bestrijden.
Tot nu toe werd aangenomen dat de verdedigingsstrategieën van bacteriën weinig gelijkenis vertoonden met die van mensen. Dit idee werd echter uitgedaagd door recente ontdekkingen van geconserveerde verdedigingscomponenten (ook wel immuunmodules genoemd, wat kan verwijzen naar complete of gedeeltelijke eiwitten) tegen micro-organismen over de hele levensboom heen. Pas in juli van dit jaar introduceerden onderzoekers een naam voor dit concept: ancestrale immuniteit.
Een gedeelde verdediging tussen bacteriën en mensen
Bacteriofagen, of kortweg fagen, zijn virussen die zich vermenigvuldigen in geïnfecteerde bacteriën. Uiteindelijk barsten de bacteriën open en worden de nieuw gevormde fagen vrijgelaten. Om zichzelf te beschermen, hebben bacteriën een indrukwekkend arsenaal aan immuunstrategieën ontwikkeld tegen deze indringers. Onderzoekers van het Weizman Institute of Science in Rehovot, Israël, beschreven onlangs een anti-faagverdedigingssysteem in bacteriën dat opvallend veel lijkt op een immuunmodule bij mensen.
In het menselijke immuunsysteem wordt een klein eiwit, ISG15, gehecht aan zowel virale als menselijke eiwitten. Dit helpt menselijke cellen om virale infecties te bestrijden via een mechanisme dat nog niet volledig is begrepen. Dit hechtingsproces vereist een specifieke set eiwitten, genaamd E1, E2, E3 en DUB.
De onderzoekers van het Weizman Institute ontdekten vier eiwitten in bacteriën die sterk lijken op deze menselijke eiwitten: een klein eiwit vergelijkbaar met ISG15 (genaamd Ubl) en drie eiwitten die lijken op E1, E2 en DUB. Deze set eiwitten werd het Bil-systeem genoemd en kon bacteriën beschermen tegen verschillende bacteriofagen. Door de sequenties van de bacteriële eiwitten te wijzigen op basis van eerder onderzoek naar het menselijke systeem, toonden de onderzoekers aan dat deze bacteriële eiwitten waarschijnlijk vergelijkbare functies vervullen als hun menselijke tegenhangers.
Aangepaste staart structuur maakt bacteriofagen “steriel”
Hoe meer fagen je toevoegt, hoe meer bacteriën in eerste instantie geïnfecteerd raken, simpelweg vanwege de hoeveelheid. Als faaginfectie de bacteriën doodt, sterven er direct meer bacteriën. Bij infectie met een kleiner aantal fagen worden aanvankelijk maar een beperkt aantal bacteriën geïnfecteerd. Deze bacteriën sterven en geven nieuwe fagen vrij, die vervolgens de rest van de bacteriën infecteren. Na verloop van tijd sterven de overgebleven bacteriën ook.
De onderzoekers ontdekten dat bacteriën met het Bil-systeem een infectie met een klein aantal fagen konden overleven, maar niet met een groot aantal. Ze kwamen met het idee dat de nieuw gevormde fagen mogelijk niet-infectieus waren voor de resterende bacteriën.
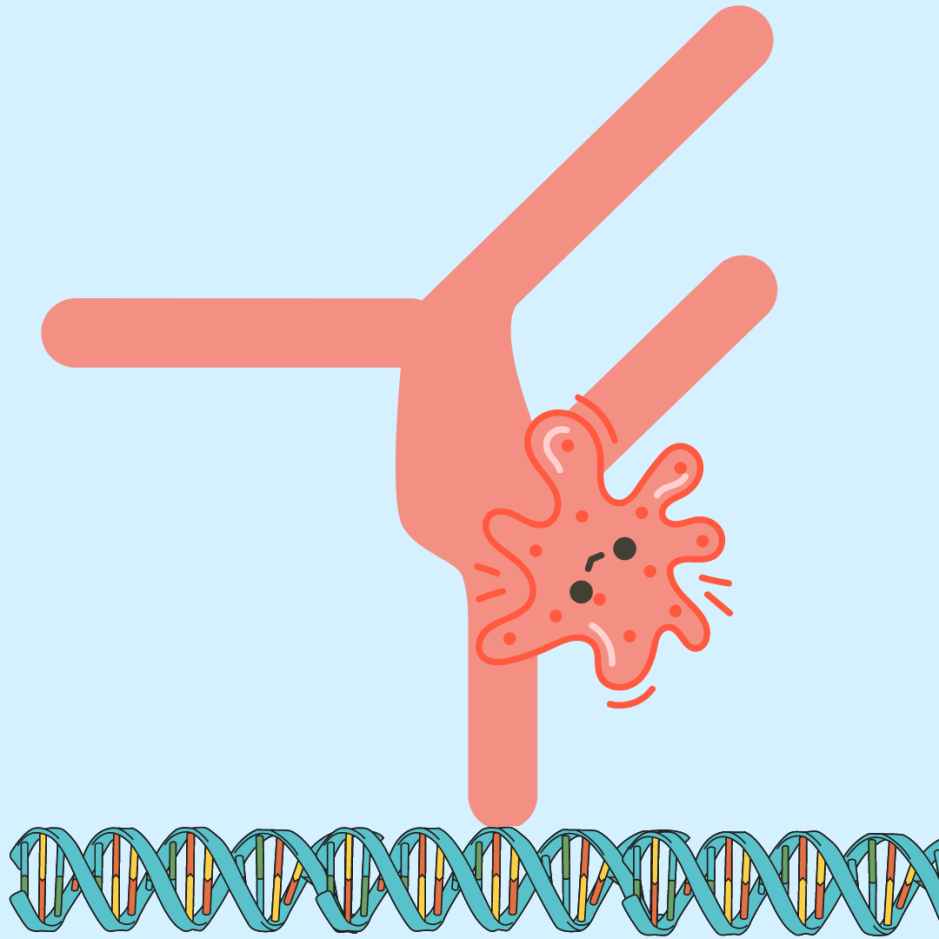
Ze isoleerden bacteriofagen uit bacterieculturen met het Bil-systeem en analyseerden ze met elektronenmicroscopie. Met deze methode kunnen zeer kleine structuren in het nanometerbereik worden gevisualiseerd. Twee verschillende faagtypes werden waargenomen: het eerste type leek normaal, met een icosahedrale kop en een staart, terwijl het tweede type de staartstructuur miste. Omdat de staart belangrijk is voor het eerste contact met de bacterie en voor het injecteren van genetisch materiaal, was dit type faag duidelijk niet-infectieus.
Maar waarom zou het eerste type, een volledig intacte faag met een staart, toch niet-infectieus zijn? De onderzoekers ontdekten dat het Bil-systeem het Ubl-eiwit heel specifiek hecht aan het CTF-eiwit, dat het uiteinde van de faagstaart vormt. Deze hechting kan resulteren in staartloze fagen (het tweede type) of in niet-infectieuze fagen met een gemodificeerde staart (het eerste type), omdat het gehechte eiwit het contact met bacteriën blokkeert.

Bacteriofagen bestaan uit een icosahedrale kop, een staart en het CTF-eiwit, dat het uiteinde van de staart vormt. In geïnfecteerde bacteriën met het Bil-systeem wordt Ubl gehecht aan het CTF-eiwit. Hierdoor ontstaan staartloze fagen of fagen met een Ubl-gemodificeerde staart, die beide niet-infectieus zijn.
Bron afbeelding: gemaakt door de auteur met BioRender.com
Een bacterieel offer voor het grotere goed
In tegenstelling tot andere verdedigingsstrategieën voorkomt het Bil-systeem niet dat de geïnfecteerde bacterie sterft. In plaats daarvan manipuleert het systeem de fagen zodat deze niet-infectieus worden voor de overige bacteriën. Het beschermt de bacteriepopulatie als geheel tegen het verspreiden van faagepidemieën dankzij de moedige of eerder ongelukkige bacteriën die zichzelf opofferen om hun soortgenoten te beschermen.
Het Bil-systeem is slechts één van de vele onlangs ontdekte immuunmodules die worden gedeeld door verschillende soorten in de levensboom. Deze ontdekkingen zouden het begin kunnen zijn van een paradigmaverschuiving in hoe onderzoekers verdedigingsstrategieën tegen micro-organismen in ver verwante soorten begrijpen en bestuderen. Bovendien biedt dit nieuwe mogelijkheden om kennis uit bacteriën te halen over het menselijke immuunsysteem – en andersom.
Link to the original post: Hör, J., Wolf, S.G. & Sorek, R. Bacteria conjugate ubiquitin-like proteins to interfere with phage assembly. Nature 631, 850–856 (2024). https://doi.org/10.1038/s41586-024-07616-5
Featured image: created by author using Bing Image Creator
Vertaald door: Mira Stas