Microbiologie in hapklare porties
Ontworpen antilichamen kunnen de toekomst van infectiebescherming zijn
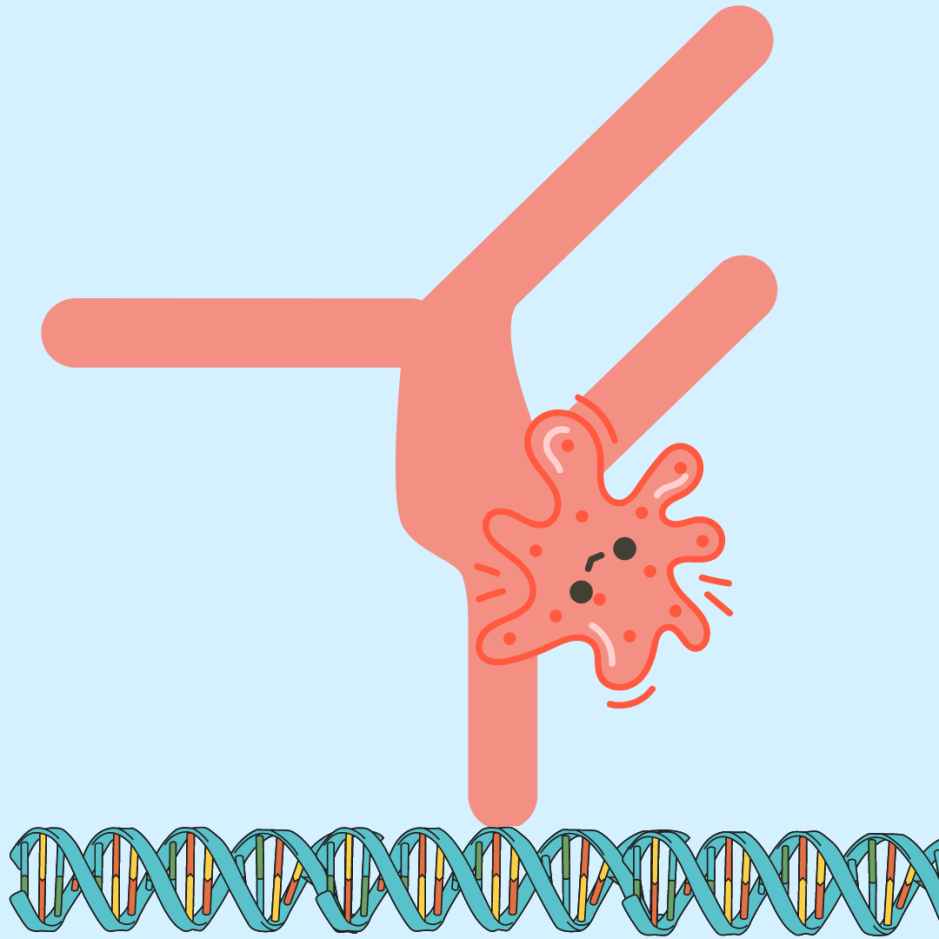
Als je ziek wordt van een virus of bacterie, maakt je lichaam antilichamen aan om de binnendringende ziekteverwekker te helpen bestrijden. Onderzoekers maken gebruik van ons immuunsysteem en dienen voor sommige ziekten extra antilichamen toe om het immuunsysteem een extra boost te geven.
Immunotherapie maakt gebruik van antilichamen om verschillende ziekten te behandelen, maar de manier waarop onze natuurlijke antilichamen zich binden aan ziekteverwekkers is niet perfect. Er zijn gemanipuleerde antilichamen ontwikkeld om ziekteverwekkers beter te herkennen en ons lichaam beter voor te bereiden op een infectie.
Nieuw onderzoek heeft een manier gevonden om deze antilichamen nog beter te maken door twee verschillende soorten te combineren. Deze hybride antilichamen kunnen zich sterk binden aan schadelijke indringers en tegelijkertijd een sterke immuunrespons activeren, wat een betere therapeutische optie biedt om schadelijke ziekten te bestrijden.
De onderzoekers begonnen hun proces om het beste hybride antilichaam te vinden door te kijken naar het effect ervan op het neutraliseren van de bacterie Streptococcus pyogenes, die een hoog sterftecijfer veroorzaakt en moeilijk te behandelen is met antibiotica.
De scharnierregio beïnvloedt de flexibiliteit van een antilichaam
Elk deel van het antilichaam kan de werking ervan beïnvloeden. De zware keten in een antilichaam helpt structuur en stabiliteit te bieden en kan helpen bepalen welk type ziekteverwekkers het antilichaam zal herkennen. Zware ketens kunnen verschillen in structuur en functie, wat de subklasse van een antilichaam bepaalt.
Het onderzoek gebruikte een antilichaam dat was gemaakt om de bacterie aan te vallen en veranderde het voor verschillende subklassen. Elke subklasse heeft een ander scharniergebied, het flexibele gebied dat de armen van de antilichamen verbindt. Ze ontdekten dat wanneer het antilichaam een IgG3-subklasse had, het een sterke immuunrespons opwekte, ook al plakte het niet zo goed aan de bacterie.
Met behulp van simulaties ontdekten ze dat IgG3 flexibeler was dan andere typen antilichamen, waardoor het mogelijk een betere interactie aangaat met immuuncellen. Ze toonden aan dat de scharnierregio van een antilichaam de werking ervan kan veranderen. De scharnierregio van IgG3 is langer dan die van sommige andere subklassen. In combinatie met zijn flexibiliteit heeft het antilichaam meer beweging.
Lengte van een antilichaam is belangrijk
De lengte van het scharnier had verschillende gevolgen. Antilichamen met een langere scharnierlengte worden meer geassocieerd met de belangrijke immuuncel fagocyt. De lange scharnierlengte zorgt er ook voor dat fagocyten de bacteriën beter opslokken. Maar de scharnierlengte had een grens. Als het te lang was, verloor het antilichaam zijn functie.

Onderzoekers pasten de scharnierlengte van verschillende antilichamen aan om hun effectiviteit in het bestrijden van ziekteverwekkers te testen. Afbeelding aangepast van Izadi et al., 2024.
De onderzoekers ontdekten dat 47 aminozuren het beste werken als scharnierlengte om bacteriën te bestrijden. Het gebruik van een antilichaam met een scharnierlengte van 47 aminozuren was geweldig in het bestrijden van de bacterie bij muizen en hielp de verspreiding van de infectie naar de milt en lever te voorkomen. Het antilichaam bleef ook het langst in het bloed aanwezig, vergeleken met antilichamen met kortere en langere scharnierlengtes.
Toen ze het onderzochten tegen andere stammen van streptococcus pyogenes, was het antilichaam effectief tegen alle stammen die ze bekeken, wat betekent dat het een veelbelovende behandeling zou kunnen zijn voor verschillende streptococcus pyogenes infecties.
Gemanipuleerde antilichamen beschermen ook tegen virussen
Toen ze zagen hoe goed het gemanipuleerde antilichaam werkte tegen bacteriën, wilden de onderzoekers de mogelijkheden ervan testen tegen een virus. Ze gebruikten antilichamen waarvan bekend was dat ze gericht waren tegen SARS-CoV-2 en gaven ze de scharnierlengte van 47 aminozuren. Ze ontdekten dat hun hybride antilichamen effectief waren in het activeren van de immuunrespons tegen het virus, het verhogen van de fagocytaire interactie en het opslokken van het virus.
Toekomstperspectieven
In het algemeen toonden de onderzoekers aan dat een lange scharnierlengte van een antilichaam de immuuncapaciteiten kan verbeteren en dat de binding van het antilichaam niet de enige factor is die het succes bepaalt. Deze vooruitgang in de ontwikkeling van antilichamen zou onderzoekers in staat kunnen stellen om antilichamen te transformeren in krachtige hulpmiddelen voor het bestrijden van een reeks infecties.
Link to the original post: Izadi, A., Karami, Y., Bratanis, E. et al. The hinge-engineered IgG1-IgG3 hybrid subclass IgGh47 potently enhances Fc-mediated function of anti-streptococcal and SARS-CoV-2 antibodies. Nat Commun 15, 3600 (2024). https://doi.org/10.1038/s41467-024-47928-8
Featured image: by the author in Biorender.com
Vertaald door: Liang Hobma