Microbiologie in hapklare porties
De evolutie van vaccins in SARS-CoV-2 virusachtervolging
Eind 2019 veroorzaakte een nieuw coronavirus genaamd SARS-CoV-2 met COVID-19 een wereldwijde crisis. Wetenschappers brachten snel vaccins op de markt, zoals mRNA-1273 en BNT162b2, met een effectiviteit van meer dan 90%. Deze vaccins, gebaseerd op de blauwdruk van het originele Wuhan-virus, hebben het aantal ernstige ziektes en sterfgevallen aanzienlijk teruggebracht. Maar naarmate het virus muteert en varianten als Beta, Delta en Omicron creëert, neemt de kracht van deze vaccins af. De Omicron-variant, die bijzonder geniepig is, heeft geleid tot bijgewerkte vaccinaties. Toch hebben ze het moeilijk tegen de nakomelingen van Omicron, met neutraliserende antilichamen die lager zijn dan bij de Wuhan-stam. Het spike-eiwit van het virus, de sleutel tot neutralisatie, blijft veranderen en ontwijkt de afweer door nieuwe mutaties. Door deze wapenwedloop zijn wetenschappers druk bezig met het ontwikkelen van nieuwe vaccins voor een bredere en duurzamere verdediging tegen deze gedaanteverwisselende vijand, met als doel de verspreiding van het virus te beperken, zelfs onder de gevaccineerden. Het is een wereldwijde sprint, waarbij oude kennis wordt gecombineerd met nieuwe ontdekkingen om een virus dat altijd een stap voor is voor te blijven.
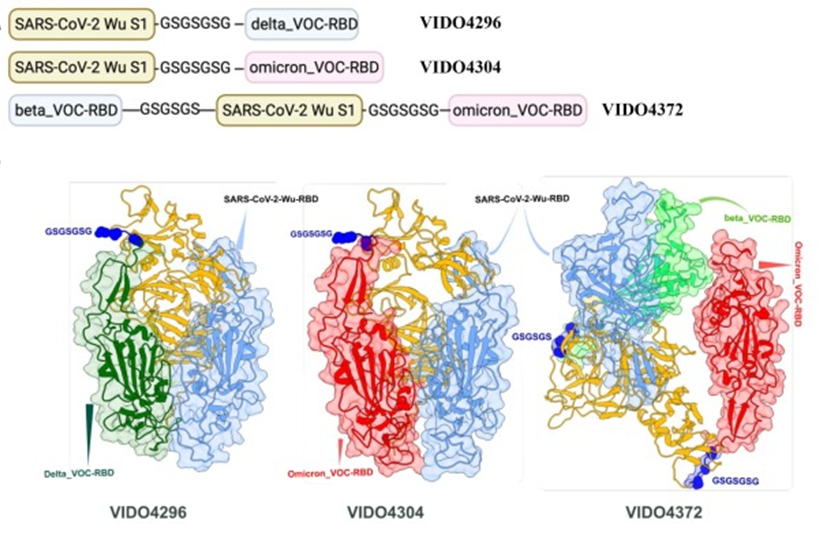
Stel je een vaccin voor dat lijkt op een trein, met als motor de Wuhan S1-sequentie van SARS-CoV-2 en als wagons de Receptor Binding Domains (RBD’s) van verschillende varianten van zorg (VOC’s). Het RBD is een kritieke regio binnen het spikeiwit van het virus en fungeert als de ‘sleutel’ door interactie met de Angiotensine-converterend enzym 2 (ACE2)-receptor van de gastheercel, waardoor het virus zich gemakkelijker kan hechten en binnenkomen. Dit innovatieve “treinmodel” dat in april 2024 werd geïntroduceerd door Ravendra Garg et al. maakt gebruik van linkers waarbij de RBD’s zijn verbonden met het Wuhan S1-eiwit via een glycine-serine flexibele linkersequentie. Dit ontwerp heeft brede bescherming aangetoond tegen SARS-CoV-2 VOC’s in het Syrische goudhamstermodel. Het is ontworpen en wordt geacht aanpasbaar te zijn, zodat componenten snel kunnen worden uitgewisseld – net als het verwisselen van treinwagons – om verschillende virusvarianten te bestrijden. De kern van het vaccin, de “locomotief”, blijft constant, namelijk het Wuhan S1 antigeen, wat zorgt voor een stabiel productieproces. De wetenschappers ontwikkelden op een slimme manier vaccinproteïnen genaamd VIDO4296, VIDO4304 en VIDO4372 die lijken op de spike van het virus, door ze te verbinden met een glycine-serine flexibele keten. Ze hadden het deltaRBD-deel in VIDO4296 vervangen door omicronRBD voor het maken van de VIDO4304-subeenheid, die beide zijn verbonden met een zeven aminozuur glycine-serine linkersequentie. Ook voor VIDO4372 voegden ze Beta en Omicron RBDs samen met dezelfde linkersequentie.
Opmerkelijk was dat toen deze eiwitten werden geglycosyleerd en gecombineerd met een hulpstof, ze potentie toonden in het voorkomen van de ziekte in hamstermodellen door hun stabiliteit en immunogeniciteit te verbeteren. Deze aanpak bouwt niet alleen voort op de eerste generatie vaccins die momenteel in klinische tests worden gebruikt, maar biedt ook een veelzijdig platform dat snel kan worden aangepast om nieuwe SARS-CoV-2 VOC’s en mogelijk andere bèta-coronavirussen te bestrijden. Het is een wetenschappelijke sprong naar een veerkrachtigere verdediging tegen de zich ontwikkelende dreiging van COVID-19.
Het vaccin VIDO4296, dat tweemaal intramusculair werd toegediend aan hamsters, toonde veelbelovende resultaten tegen verschillende stammen van SARS-CoV-2. Na vaccinatie werden deze dieren gevaccineerd. Na de vaccinatie werden deze dieren blootgesteld aan de Omicron, Delta en Beta varianten. De gevaccineerde groep had een minimaal gewichtsverlies en nam dit snel weer op, wat duidt op herstel van de gezondheid. Hun bloed bevatte met name hoge concentraties antilichamen die in staat waren de Delta-variant te neutraliseren, een teken van een sterke immuunrespons. De controledieren daarentegen vertoonden een vertraagde gewichtstoename en hadden deze antilichamen niet. Bovendien verminderde het vaccin de virusniveaus in de neusholten aanzienlijk, wat het potentieel van het vaccin om de overdracht te beperken benadrukt. Hamsters geïmmuniseerd met VIDO4372 produceerden ook hoge anti-S1 antilichaamresponsen, terwijl hamsters geïmmuniseerd met VIDO4304 sterke neutraliserende antilichamen tegen Omicron- en Delta-varianten lieten zien. In diermodellen hebben de van dit platform afgeleide vaccins hun effectiviteit aangetoond, waarbij een sterke antilichaamrespons werd opgewekt die bestond uit zowel neutraliserende als bindende antilichamen en deze reacties hielden 48 dagen na de eerste immunisatie aan en bleven hoog, zelfs nadat het virus was blootgesteld. Bovendien had de meerderheid van de gevaccineerde dieren op dag 5 na de infectie geen aantoonbaar virus meer in hun luchtwegen, die sterk verlaagde virale titers vertoonden. Dit suggereert dat deze vaccinaties een brede bescherming kunnen bieden tegen verschillende vormen van SARS-CoV-2 die zorgen baren (VOC’s). De veelzijdigheid van het platform wordt verder benadrukt door het vermogen om een consistent upstream- en downstreamproces te handhaven, zelfs wanneer de antigene componenten worden gewijzigd om overeen te komen met circulerende stammen.
De stabiliteit van deze nieuwe vaccins werd gedurende 13 maanden bij koelkasttemperaturen (2-8°C) gevolgd. Opmerkelijk is dat VIDO4296 alle antigeenintegriteit behield en dat VIDO4304 en VIDO4372 50-75% integriteit vertoonden. Deze vaccins zijn mogelijk betaalbaarder om te maken dan mRNA-vaccins vanwege hun stabiliteit, geen significante veranderingen in kritieke eigenschappen en het gebruik van gemakkelijk toegankelijke hulpstoffen. Bovendien hoeven deze subunitvaccinaties niet te worden opgeslagen bij extreem lage temperaturen, wat de distributielogistiek eenvoudiger en goedkoper maakt, vooral in omgevingen met beperkte middelen. De architectuur van het “trein model” platform maakt het dus mogelijk om zich snel aan te passen aan nieuwe VOC’s, wat een snelle reactie op nieuwe gevaren mogelijk kan maken zonder dat er grote veranderingen in het productieproces nodig zijn.
Hoewel het onderzoek zich richtte op de humorale immuunrespons, erkennen de wetenschappers het belang van het beoordelen van celgemedieerde immuniteit, wat ze van plan zijn te onderzoeken zodra er meer reagentia beschikbaar zijn voor hun diermodellen. De voorlopige gegevens zijn echter veelbelovend en laten zien dat de kandidaat-vaccins beschermende niveaus van neutraliserende antilichamen kunnen opwekken en de klinische resultaten kunnen verbeteren. De lat voor de toekomst ligt vrij hoog met het doel om het volledige potentieel van dit platform te benutten om vaccins te maken die een brede bescherming kunnen bieden tegen een reeks zoönotische ziekteverwekkers.
Link to the original post: Ravendra Garg et al., (2024). Vaccine,
Featured image: Bing AI Designer
Vertaald door: Liang Hobma