Microbiologie in hapklare porties
Hoe win je een wapenwedloop: lessen uit “roze bessen”?
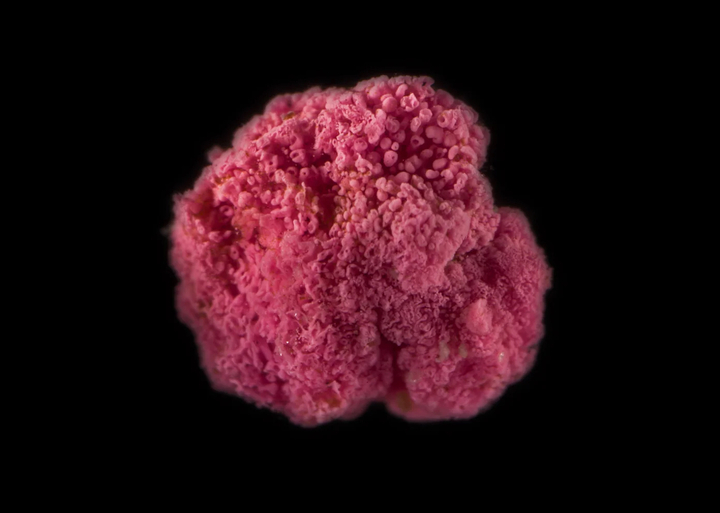
In getijdenpoelen in het hoge zoutmoeras in Cape Cod ontdek je soms merkwaardige felroze bessen in de modder. Deze mysterieuze “roze besjes” zijn helemaal geen besjes, maar bacteriële gemeenschappen die inzicht geven in de evolutie van het meercellige leven.

Er is veel mysterie rond deze “bessen”. Ten eerste vormen ze een dichte populatie van slechts een paar soorten, wat betekent dat de meeste organismen in de bessen nauw aan elkaar verwant zijn. Zoals we hebben geleerd tijdens de COVID-19 pandemie, is dit een situatie die virussen goed kunnen uitbuiten. Hoe kunnen de bacteriën in roze bessen (en bij uitbreiding andere vormen van meercellig leven) zich zonder sociale afstand en maskers beschermen tegen virale aanvallen?
Roze bessen zijn een uitstekend model voor de evolutie van meercellig leven in het algemeen. Daarom ging een team onderzoekers op zoek naar een van de meest voorkomende organismen in roze bessen: PB-PSB1, een fototrofe paarse zwavelbacterie, wat betekent dat het licht en zwavel gebruikt om energie te oogsten. Wat ze vonden in het enorme genoom van PB-PSB1 daagt onze perceptie van de bacteriële immuunfunctie uit. Deze bacterie lijkt zijn antivirale sensoren aan te scherpen met behulp van geavanceerde mechanismen voor snelle en gerichte mutatie.
De fagen bijhouden
Om hun ontdekking te verklaren, moeten we iets begrijpen dat een “diversiteit genererend retroelement” (DGR) wordt genoemd. Een retro-element is een stukje DNA dat zich verplaatst in het genoom van zijn gastheerorganisme door te worden getranscribeerd in RNA, vervolgens terug te “reverse-transcriberen” in DNA en opnieuw in te voegen op een nieuwe locatie in het genoom. DGR zijn retro-elementen die worden teruggeschreven door een enzym dat gespecialiseerd is in foutgevoeligheid – het is geëvolueerd om slecht te zijn in zijn werk. Dit betekent dat wanneer het DNA opnieuw in het genoom wordt geplaatst, de volgorde willekeurig is veranderd. Elke DGR richt zich op een specifieke regio van een gen. Deze regio ondergaat regelmatig willekeurige mutaties.

Waarom zou een cel willekeurige mutaties willen genereren? In het algemeen zijn grote hoeveelheden willekeurige mutatie niet goed. We vertrouwen erop dat eiwitten hun werk doen en geen willekeurige, functieveranderende mutaties hebben. Voor sommige soorten sequenties kan deze willekeurige mutatie echter een goede zaak zijn.
Stel je een eiwit voor dat werkt als een sensor. Het kan zich binden aan bepaalde DNA-sequenties en zo de aanwezigheid van deze sequenties detecteren. Stel je nu voor dat de sequentie waar het eiwit naar zoekt snel evolueert om detectie te ontlopen. In dat scenario kan het zeer gunstig zijn voor het sensorgebied om veelvuldige mutaties te hebben, zodat sommige van zijn gemuteerde vormen waarschijnlijk zullen binden aan het snel muterende doel-DNA dat het hoopt te herkennen.
Dit is het geval bij de “wapenwedloop” tussen virussen en de cellen die ze hopen te infecteren. Virussen muteren voortdurend in de hoop detectie te ontlopen, terwijl hun gastheren proberen hun detectievermogen op peil te houden.
Een nieuwe vorm van bacteriële adaptieve immuniteit?
In het genoom van PB-PSB1 viel de auteurs van deze nieuwe studie iets opvallends op: het bevat negen DGR’s die gericht zijn op regio’s in vijftien genen. Dit is opmerkelijk: slechts 0,04% van de bestudeerde bacteriën bevat meer dan twee volledige DGR’s. Geïntrigeerd namen ze de doelgenen van deze veelheid aan DGR’s onder de loep om hun functie te begrijpen.
Ze ontdekten dat de meeste doelgenen van PB-PSB1’s DGR’s waarschijnlijk functioneren als antigeensensoren, wat betekent dat ze ongewenst DNA van een virale indringer detecteren zodat de cel kan reageren op infectie. Gerichte mutatie van zulke sensoren is vrij zeldzaam. Deze ontdekking geeft aan dat sommige bacteriën mogelijk een geavanceerder en complexer immuunsysteem hebben dan eerder werd gedacht. Als de auteurs van dit onderzoek gelijk hebben, hebben ze een systeem ontdekt dat in sommige opzichten vergelijkbaar is met de adaptieve immuniteit van gewervelde dieren.
Het grotere plaatje
Deze strategie kan wijdverbreid blijken te zijn onder bacteriën die in meercellige consortia leven. Door te zoeken naar verwante DGR’s in gepubliceerde sequenties, hebben de onderzoekers mogelijk vergelijkbare immuunfuncties geïdentificeerd in een aantal andere bacteriën. Een groot deel (82%) van de bacteriën die DGR’s bevatten die verwant zijn aan PB-PSB1 hebben een meercellige levensstijl.
Het is evolutionair gunstig voor bacteriën met een meercellige levensstijl om prioriteit te geven aan het overleven van de meeste cellen in de gemeenschap boven elke individuele cel, zoals te zien is bij vergelijkbare levensvormen, zoals dieren en planten die een vergelijkbare evolutionaire druk ervaren. De overvloed aan DGR’s in deze bacteriën geeft aan dat deze manier van immuunfunctie bijzonder belangrijk is voor meercellig leven.
Gezien de uitdaging van het leven in de nabijheid van zeer nauwe genetische verwanten, is het niet verrassend dat een verfijnde immuunfunctie essentieel is voor deze organismen. De ontdekking van zulke verfijnde immuunmechanismen is niettemin opvallend en geeft aan dat mutatie-gebaseerde adaptieve immuniteit eerder evolueerde en wijder verspreid is dan eerder werd gedacht.
Link to the original post: Doré, H., Eisenberg, A. R., Junkins, E. N., Leventhal, G. E., Ganesh, A., Cordero, O. X., Paul, B. G., Valentine, D. L., O’Malley, M. A., & Wilbanks, E. G. (2024). Targeted hypermutation of putative antigen sensors in multicellular bacteria. Proceedings of the National Academy of Sciences, 121(9), e2316469121. https://doi.org/10.1073/pnas.2316469121
Featured image: Image source: wilbankslab.org
Vertaald door: Liang Hobma