Microbiologie in hapklare porties
Ebola-virus sluipt naar buiten door celtunnels
Written by
Neelabh Datta
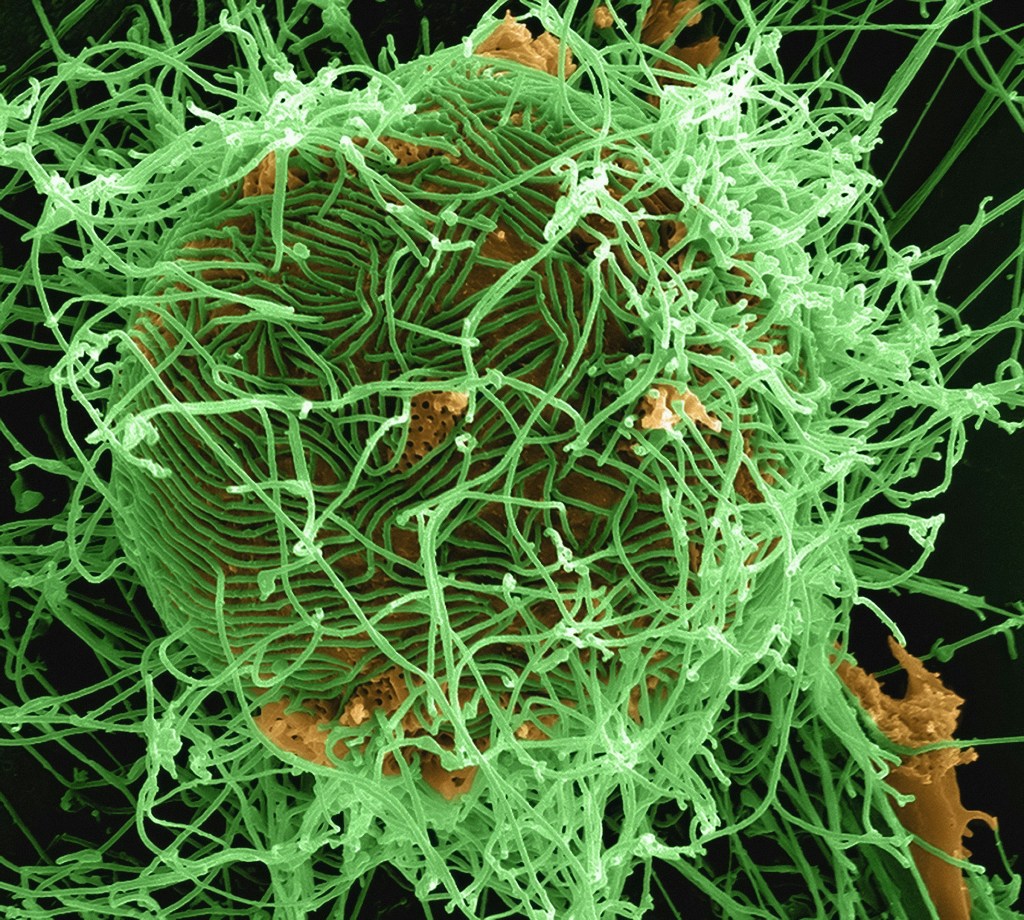
Het ebolavirus (EBOV) is een dodelijk RNA-virus dat hemorragische koorts veroorzaakt bij mensen en dieren. Het infecteert macrofagen en andere cellen door macropinocytose, een proces waarbij extracellulaire vloeistof en deeltjes worden opgeslokt. Het virus heeft een negatiefstrengs RNA-genoom dat wordt ingekapseld door verschillende virale eiwitten die verschillende stappen van de virale levenscyclus bemiddelen, zoals binnendringen, replicatie, transcriptie, nucleocapside assemblage en uittreding. Om zich efficiënt te verspreiden, maakt EBOV gebruik van tunneling nanotubes (TNT’s), lange en dunne cytoplasmatische uitlopers die twee cellen met elkaar verbinden en de overdracht van cellulair materiaal mogelijk maken. TNT-gemedieerde virale genoomoverdracht kan ook het aantal gastheercellen dat geïnfecteerd kan worden vergroten, wat leidt tot ernstigere ziekte-uitkomsten. In een recent onderzoek in 2023 toonden Djurkovic et al. een nieuw mechanisme van EBOV-verspreiding aan waarbij deze gespecialiseerde nanobuisjes en nucleocapsidetransport betrokken zijn, naast het conventionele vrijkomen van virionen van het celoppervlak.
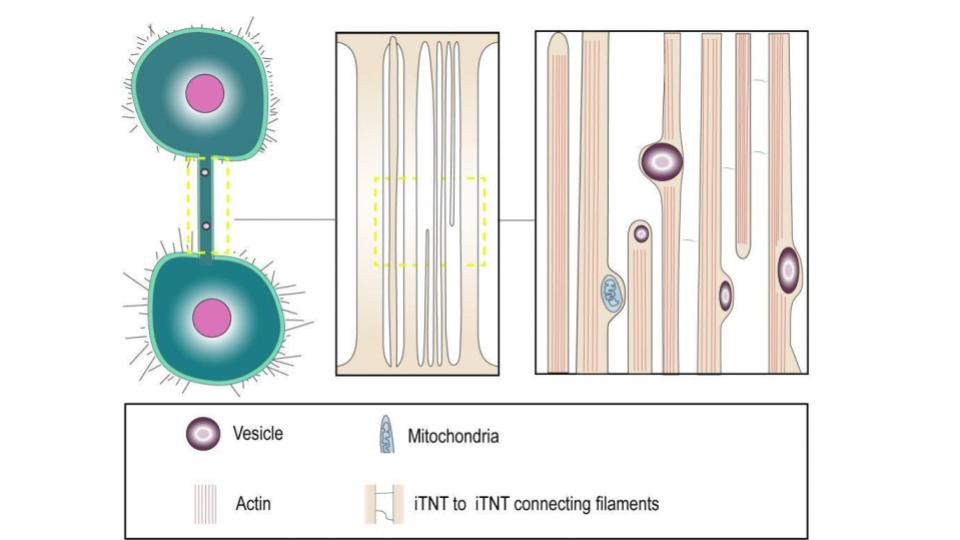
Ze ontdekten dat alleen de TNT’s die tubuline bevatten en cellulaire organellen transporteerden, ook virale componenten bevatten, zoals eiwitten en RNA die het EBOV tussen cellen kon overbrengen zonder infectie te veroorzaken. EBOV kon zijn infectie hervatten in cellen die werden behandeld met medicijnen die virusinsleep blokkeren, wat impliceert dat het virus zich kon vermenigvuldigen zonder de cellen binnen te dringen. Met EBOV geïnfecteerde macrofagen hadden hogere ATP-niveaus, wat erop wijst dat het virus mitochondriale functies zou kunnen gebruiken of veranderen in zijn voordeel.
EBOV interageerde met mitochondriale complexen en werd gevonden in de buurt van mitochondriën in geïnfecteerde cellen, die energie zouden kunnen leveren voor de virusreplicatiecyclus, zoals het maken en vrijgeven van nieuwe virusdeeltjes [3]. De onderzoekers rapporteerden ook dat EBOV de activering van de mitochondriale antivirale signaal-eiwitroute, die essentieel is voor de immuunrespons, verhinderde door type I interferonen te produceren. Ze legden uit dat EBOV dit deed door te interfereren met de binding van viraal RNA aan de RIG-I receptor en ook de mitochondriale dynamiek te beïnvloeden [4].
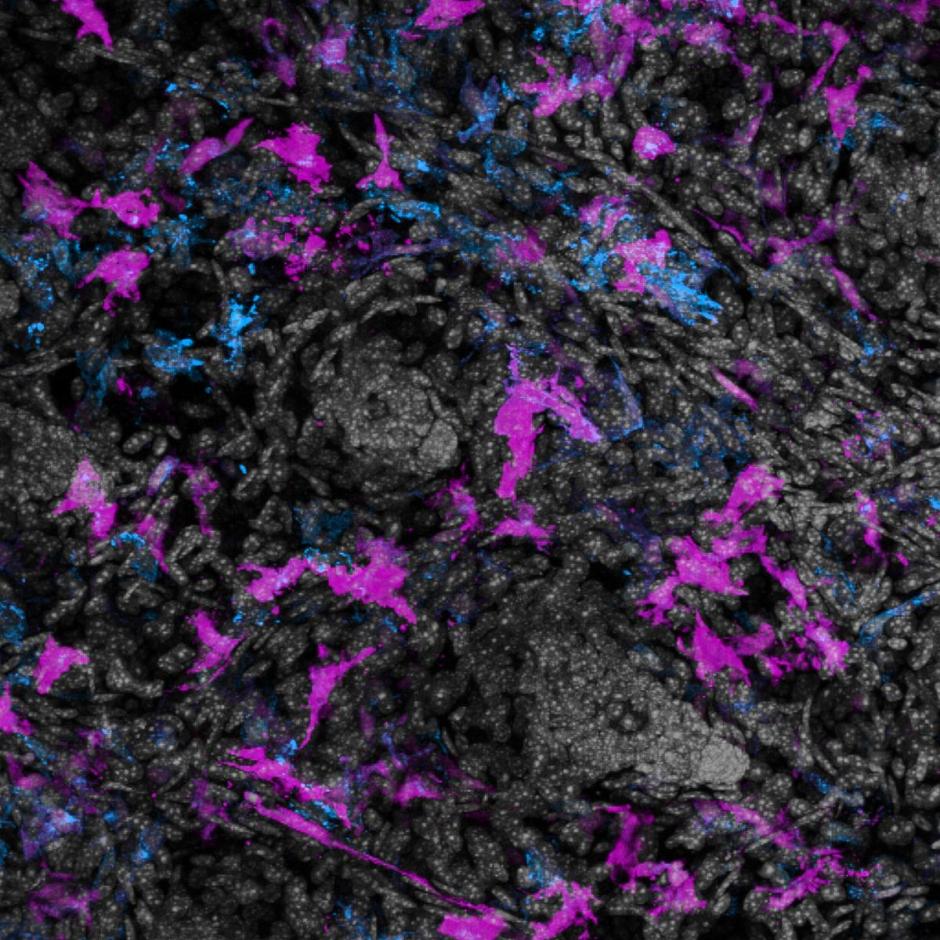
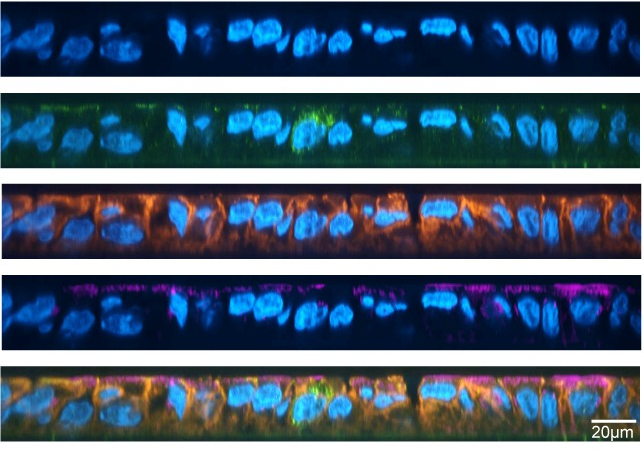
Met EBOV geïnfecteerde macrofagen werden gekleurd met antilichamen die binden aan eiwitten zoals het matrixeiwit (VP40), virale glycoproteïne (GP) en virale nucleoproteïne (NP), die betrokken zijn bij de assemblage en het uittreden van virusdeeltjes. VP40 en GP werden gedetecteerd in sommige TNT’s die geïnfecteerde cellen met elkaar verbinden, maar niet altijd in dezelfde nanobuisjes. Virale genomen die geassocieerd waren met NP-eiwitten werden ook gedetecteerd in de nanobuisjes, wat erop wijst dat virale genomen kunnen bewegen binnen de nanobuisjes geïnduceerd door EBOV-infectie. Er werd dus verondersteld dat EBOV VP40 en GP zouden interageren met de nanobuisjes.

De onderzoekers stelden ook vast dat genetisch EBOV-materiaal de nanobuisjes kon induceren en er doorheen kon reizen zonder infectie. Dit heeft belangrijke implicaties voor de persistentie en het opnieuw opduiken van EBOV, omdat bekend is dat EBOV RNA in immuun geprivilegieerde weefsels, zoals het oog, de hersenen en de testes, gedurende lange tijd na herstel kan achterblijven en een nieuwe infectie kan veroorzaken met een soortgelijke sequentie. Er werd gespeculeerd dat de nanobuisjes de verplaatsing van EBOV RNA in deze weefsels zouden kunnen vergemakkelijken, aangezien nanobuisjes betrokken zijn bij intercellulaire communicatie en transport in de hersenen en het oog.
Ze ontdekten dat deze virale structuren langs de nanobuisjes werden verspreid en zich naar aangrenzende cellen bewogen. Hierdoor konden ze concluderen dat het genetisch materiaal van EBOV de vorming van nanobuisjes in gang kan zetten en zich er op een virusonafhankelijke manier doorheen kan verplaatsen. De werkzaamheid van bestaande anti-EBOV-medicijnen die GP als doelwit hebben, werd getest en daaruit bleek dat ze de EBOV-replicatie of -verspreiding in macrofaagkweken via nanobuisjes niet konden voorkomen. Dit gaf aan dat EBOV deze medicijnen kan omzeilen door een virusvrije manier van overdracht te gebruiken en dat het kan overleven in sommige weefsels die ontoegankelijk zijn voor de medicijnen.
De onderzoekers gebruikten het EBOV-GFP-complex om primaire menselijke macrofagen te infecteren. Ze waren geïnteresseerd in het observeren van de vorming van nanobuisjes die positief waren voor infectie maar geen invloed hadden op de celoverleving na 24 uur. 24 uur is de tijd die nodig is voor één virale genoomreplicatiecyclus. De geïnfecteerde cellen werden gekleurd met fluorescerende phalloidinekleuring en antilichamen om F-actine, viraal NP en TNFAIP2 te detecteren, een gastheereiwit dat essentieel is voor TNT-vorming en -lokalisatie. Ze ontdekten dat de TNT’s zowel TNFAIP2 als viraal NP bevatten en vrij in het medium zweefden.
Ze toonden ook aan dat macrofagen TNT’s konden vormen met menselijke navelstrengendotheelcellen, die worden gebruikt om endotheelinfectie met EBOV te modelleren. Dit wijst erop dat macrofagen de overdracht van het virus naar verschillende celtypen via TNT’s kunnen vergemakkelijken, waardoor de celinfectie toeneemt. Het TNFAIP2-eiwit werd ook geassocieerd met TNT’s in met EBOV geïnfecteerde macrofagen. De auteurs stelden de hypothese dat EBOV-infectie een pro-inflammatoire omgeving creëert die de ontwikkeling van TNT bevordert, zoals blijkt uit de upregulatie van verschillende cytokines die verband houden met ontsteking en mortaliteit. Bovendien stelden de onderzoekers vast dat virale genomen langs TNT’s werden getransporteerd in macrofagen geïnfecteerd met EBOV. Deze waarneming werd ook gedaan bij andere, vergelijkbare typen filovirussen die ontstekingen induceren, wat suggereert dat TNT’s een rol kunnen spelen bij de verspreiding en pathogenese van filovirussen door het virus af te schermen tegen immuundetectie en de afweer van de gastheer te omzeilen. Deze bevindingen in dit artikel vergroten de kennis over EBOV-replicatie en bieden nieuwe mogelijkheden voor antivirale interventie.
Additional Readings
Feldmann, H., Sprecher, A., & Geisbert, T. W. (2020). Ebola. The New England journal of medicine, 382(19), 1832–1842. https://doi.org/10.1056/NEJMra1901594
Batra, J., Hultquist, J. F., Liu, D., Shtanko, O., Von Dollen, J., Satkamp, L., Jang, G. M., Luthra, P., Schwarz, T. M., Small, G. I., Arnett, E., Anantpadma, M., Reyes, A., Leung, D. W., Kaake, R., Haas, P., Schmidt, C. B., Schlesinger, L. S., LaCount, D. J., Davey, R. A., … Krogan, N. J. (2018). Protein Interaction Mapping Identifies RBBP6 as a Negative Regulator of Ebola Virus Replication. Cell, 175(7), 1917–1930.e13. https://doi.org/10.1016/j.cell.2018.08.044
Cárdenas, W. B., Loo, Y. M., Gale, M., Jr, Hartman, A. L., Kimberlin, C. R., Martínez-Sobrido, L., Saphire, E. O., & Basler, C. F. (2006). Ebola virus VP35 protein binds double-stranded RNA and inhibits alpha/beta interferon production induced by RIG-I signaling. Journal of virology, 80(11), 5168–5178. https://doi.org/10.1128/JVI.02199-05
Rustom, A., Saffrich, R., Markovic, I., Walther, P., & Gerdes, H. H. (2004). Nanotubular highways for intercellular organelle transport. Science (New York, N.Y.), 303(5660), 1007–1010. https://doi.org/10.1126/science.1093133
Delage, E., Cervantes, D. C., Pénard, E., Schmitt, C., Syan, S., Disanza, A., Scita, G., & Zurzolo, C. (2016). Differential identity of Filopodia and Tunneling Nanotubes revealed by the opposite functions of actin regulatory complexes. Scientific reports, 6, 39632. https://doi.org/10.1038/srep39632
Featured image: NIAID https://www.flickr.com/photos/niaid/14674486019/
Vertaald door: Liang Hobma