Microbiologie in hapklare porties
Speeksel bevordert overdracht van Dengue virus
Muggen, de vloek van elke zomer. Deze beestjes verpesten graag een perfect verzorgde picknick of gewoon een ontspannen wandeling in de buitenlucht met hun dorst (en honger) naar bloed. Niet alleen kunnen deze vliegende insecten een tijdelijk ongemak zijn als je een frisse neus probeert te halen, maar ze kunnen ook enkele van ‘s werelds dodelijkste ziekten overbrengen, zoals malaria en in het geval van dit artikel het Dengue-virus.
Wat is het Dengue-virus?
Ongeveer 50% van de wereld loopt het risico op Dengue. Dengue komt het meest voor in de tropische en subtropische gebieden van de wereld. Dengue is een virale infectie die wordt overgedragen door de beet van muggen, in het bijzonder de Aedes aegypti-mug. Wanneer muggen bijten, laten ze natuurlijk ook wat speeksel los in je bloed en dit artikel ging dieper in op de hulp die dit speeksel biedt aan het Dengue-virus.
De mysteries van muggenspuug
Talrijke studies hebben aangetoond dat speeksel van muggen de besmettelijkheid van door muggen overgedragen ziekteverwekkers verhoogt. Als gevolg hiervan is er veel interesse in het onderzoeken van de factoren in het speeksel die voor deze verbetering zorgen. De auteurs van dit artikel onderzochten zo’n factor, genaamd subgenomic flaviviral RNA (sfRNA). Dit is een RNA-streng die niet codeert voor eiwitten en een kleiner deel is van het flavivirale RNA-genoom (gRNA). Flavivirus is het geslacht van het virus waartoe het Denguevirus behoort. Om de functies van dit sfRNA te onderzoeken, infecteerden de onderzoekers A. aegypti-muggen oraal met een stam van het Dengue-virus type 2, de New Guinea C-stam (DENV2 NGC). Om te bevestigen dat er sfRNA’s in het speeksel van de geïnfecteerde muggen aanwezig waren, voerden de onderzoekers een Northern Blot uit, waarmee de aanwezigheid van RNA in een monster (in dit geval speeksel) wordt gedetecteerd.
Allemaal aan boord van de EV Express
Eenmaal bevestigd, stelden de wetenschappers de vraag waar deze sfRNA’s zich in het speeksel bevinden. Om dit te bereiken werd geïnfecteerd speeksel behandeld met ribonucleases (RNases), enzymen die RNA afbreken in kleinere componenten. Wat ze ontdekten was dat sfRNA in niet-geïnfecteerd speeksel werd afgebroken door de RNases, terwijl sfRNA in geïnfecteerd speeksel bestand was tegen de behandeling met RNases.
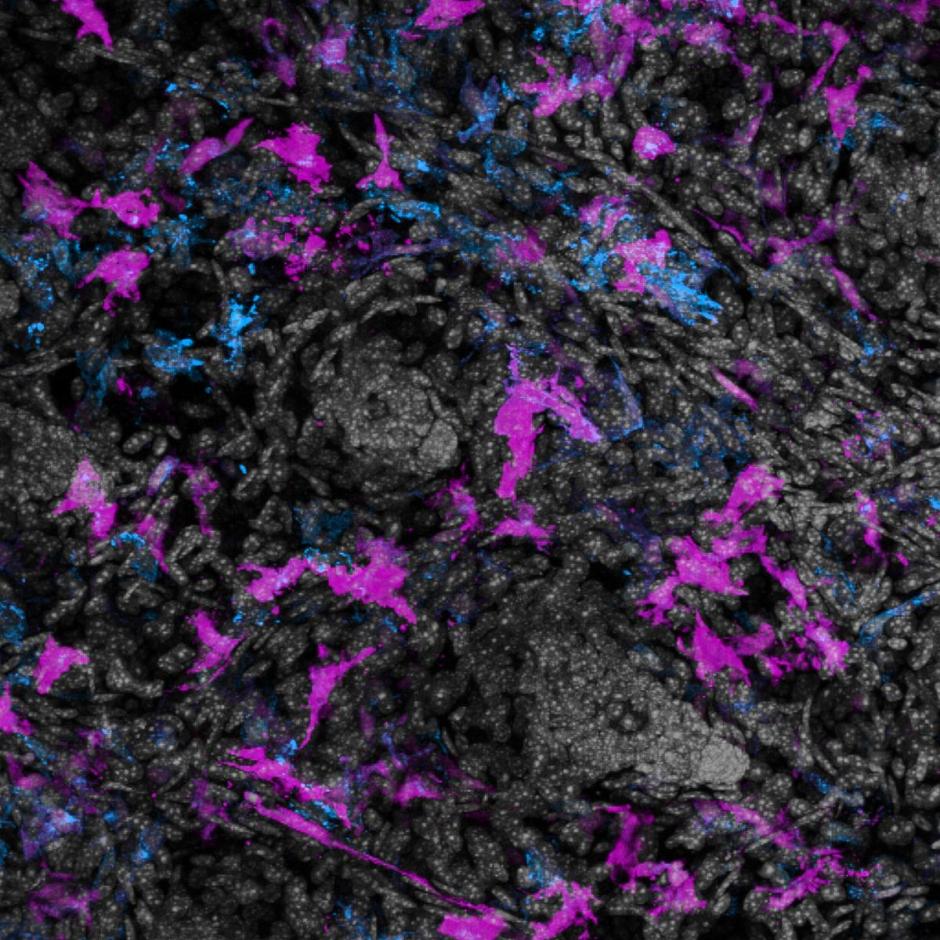
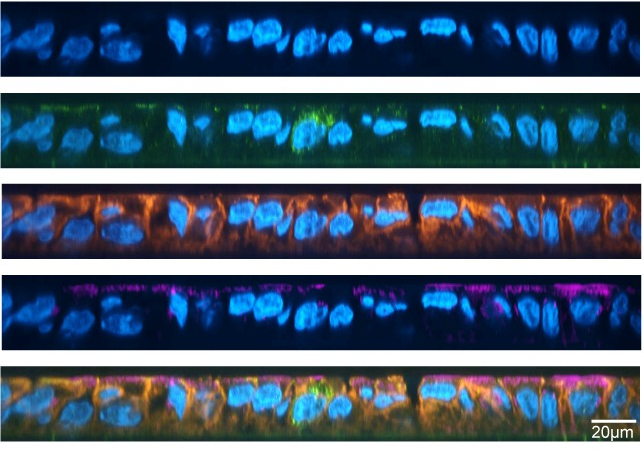
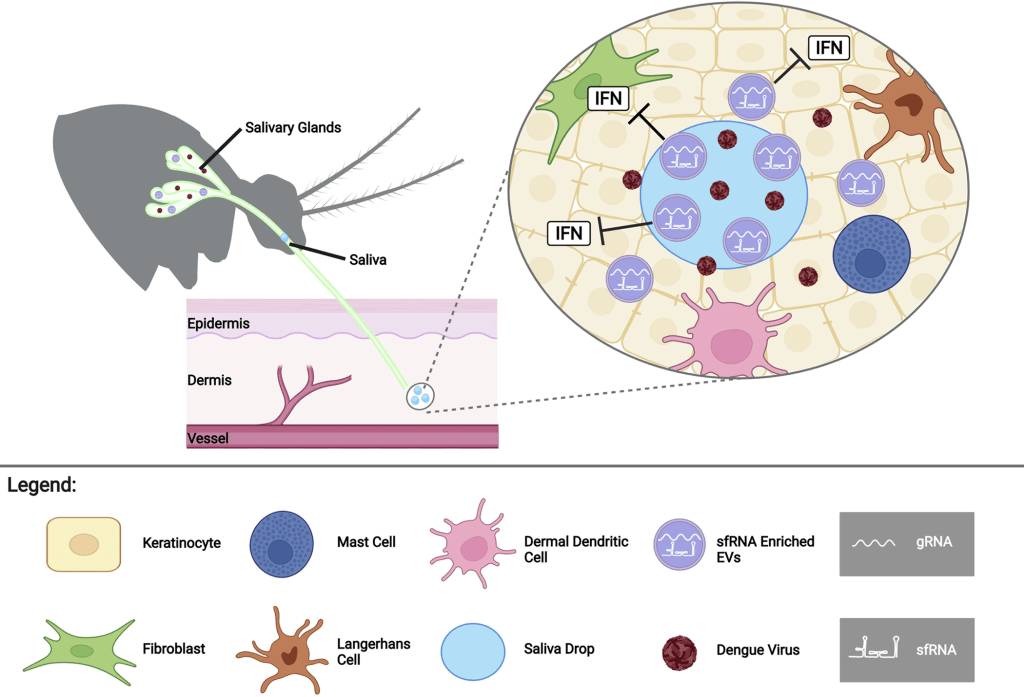
Als het geïnfecteerde speeksel echter werd voorbehandeld met een detergens (Triton X-100), werd het sfRNA afgebroken door de RNases. De onderzoekers concludeerden dat het sfRNA in geïnfecteerd speeksel een structuur heeft die het beschermt tegen afbraak door deze ribonucleasen, maar dat deze structuur kan worden aangetast door detergentia. Op basis van deze bevindingen stelden de onderzoekers de hypothese dat sfRNA waarschijnlijk wordt vastgehouden in de extracellulaire blaasjes (EV) in het speeksel. Dit zijn deeltjesachtige structuren die ontstaan uit het celmembraan en worden gebruikt om noodzakelijke materialen af te leveren aan andere cellen (figuur 1).

Eerst werd transmissie-elektronenmicroscopie gebruikt om EV-achtige deeltjes te identificeren in zowel niet-geïnfecteerde als geïnfecteerde speekselmonsters. Daarna gebruikten de wetenschappers een techniek genaamd RNA-FISH om te bevestigen dat sfRNA inderdaad in deze EV-achtige deeltjes zat. RNA-fluorescentie in situ hybridisatie (FISH) is een methode om RNA in een gefixeerd monster te detecteren en lokaliseren. Er wordt een fragment van enkelstrengs nucleïnezuur gebruikt dat is gekoppeld aan een fluorescerende kleurstof, een probe genaamd. Deze probe bindt zich aan de complementaire sequentie van viraal RNA in het speeksel, fluoresceert en kan worden gevisualiseerd met microscopie. Onderzoekers detecteerden talrijke EV’s gelabeld met de fluorescerende probes in het geïnfecteerde speeksel, wat duidt op de aanwezigheid van sfRNA in de deeltjes.
Infectie verbeterd
Nu inderdaad is bevestigd dat sfRNA voorkomt in het speeksel van muggen die zijn geïnfecteerd met het Dengue-virus, gingen de onderzoekers na hoe deze sfRNA’s de infectiviteit van Dengue bevorderen. Speeksel van muggen geïnfecteerd met verschillende DENV2-stammen werd gebruikt om een menselijke cellijn te infecteren. Deze speekselmonsters werden samengevoegd op basis van stam en elke pool had een variërend sfRNA-niveau. Interessant genoeg vonden de onderzoekers dat hoe hoger het sfRNA-niveau, hoe meer virale replicaties er waren. Om deze bevindingen verder uit te werken transfecteerden onderzoekers een streng RNA van een deel van het Dengue-genoom, als een manier om sfRNA-afgifte na te bootsen, in een menselijke cellijn 2 uur voorafgaand aan een daaropvolgende DENV2-infectie. Deze transfectie verhoogde de niveaus van DENV2 RNA in geïnfecteerde cellen aanzienlijk.
Vaarwel immuniteit
Om het effect van het sfRNA op infectiviteit verder te onderzoeken, keken de onderzoekers ook naar de gastheerrespons op DENV2 sfRNA. De reactie van de gastheer op infectie bestaat uit 2 soorten immuunreacties: adaptieve immuniteit en aangeboren immuniteit. Voor dit experiment keken de onderzoekers naar aangeboren immuniteit, de eerste verdedigingslinie van het lichaam tegen ziekteverwekkers. Deze reacties zijn niet-specifiek en algemeen, wat betekent dat ze geen onderscheid maken op basis van de ziekteverwekker. Eén aspect van aangeboren immuniteit is een groep eiwitten genaamd interferonen (IFN’s) die reageren wanneer het lichaam geïnfecteerd is met een virus. Om te kijken hoe sfRNA de interferonrespons beïnvloedt, herhaalden de auteurs het vorige experiment waarbij sfRNA in cellen werd getransfecteerd. Deze keer maten ze de interferonniveaus door het niveau van mRNA te meten voor zowel IFN’s als een groep genen die reageren op de productie van interferonen, interferon-stimulerende genen (ISG’s) genaamd, die helpen de virale replicatie te remmen. Een normale transfectie van vreemd RNA zou de mRNA-spiegels van zowel IFN’s als ISG’s verhogen, maar de streng die sfRNA nabootst onderdrukte de mRNA-spiegels van zowel interferon als interferon-stimulerende genen, wat erop wijst dat sfRNA de interferon-inductie en -signalering in menselijke cellen remt. Een geremde interferonrespons betekent een verminderde immuunrespons en een toename van de infectiviteit van het Dengue-virus.
Muggen zullen een zomerplaag blijven, maar met nieuwe inzichten in de overdrachtsfactoren van ziekteverwekkers die samenhangen met de overdrachtsroute van muggen, kunnen we beginnen met het ontwikkelen van nieuwe therapeutica om deze microben te bestrijden.
Link to the original post: Yeh SC, Strilets T, Tan WL, Castillo D, Medkour H, et al. (2023) The anti-immune dengue subgenomic flaviviral RNA is present in vesicles in mosquito saliva and is associated with increased infectivity. PLOS Pathogens 19(3): e1011224. https://doi.org/10.1371/journal.ppat.1011224
Featured image: Image by Егор Камелев from Pixabay
Vertaald door: Liang Hobma