Microbiologie in hapklare porties
Huidmicrobiota verdedigt kolonisatie door Candida auris
Je hebt misschien wel eens gehoord van gisten. Het zijn de populaire schimmels die worden gebruikt bij het rijzen van het deeg voor brood en andere bakkerijen, maar die ook berucht zijn om het veroorzaken van huidinfecties. Eén zo’n gist is Candida die candidiasis veroorzaakt. Dit geslacht omvat de grootste medisch belangrijke gisten die verantwoordelijk zijn voor infecties bij de mens, met meer dan 200 soorten! Van deze soorten vallen er een paar op door hun impact op ons wereldwijde gezondheidssysteem, en dit artikel gaat over Candida auris, de opkomende multiresistente schimmel ziekteverwekker.
Candidiasis en de gevolgen ervan, in het kort…
CDC definieert candidiasis als de schimmel (gist) infectie die ontstaat wanneer de doorgaans rustige Candida die op de huid en in ons lichaam leeft, uit de hand groeit en (negatief) gedijt in of op ons lichaam.
In de allereerste lijst van gezondheidsbedreigende schimmels die de WHO in 2022 uitbracht, neemt Candida auris de tweede plaats in. In feite vermeldt het rapport dat de totale mortaliteit van invasieve candidiasis varieert van 29% tot 53%. In een door CDC genoemde studie bleek candidemie (de meest voorkomende vorm van invasieve candidiasis) een sterfte van 19-24% te hebben.
Analyse van Candida auris om strategieën ertegen te bestrijden
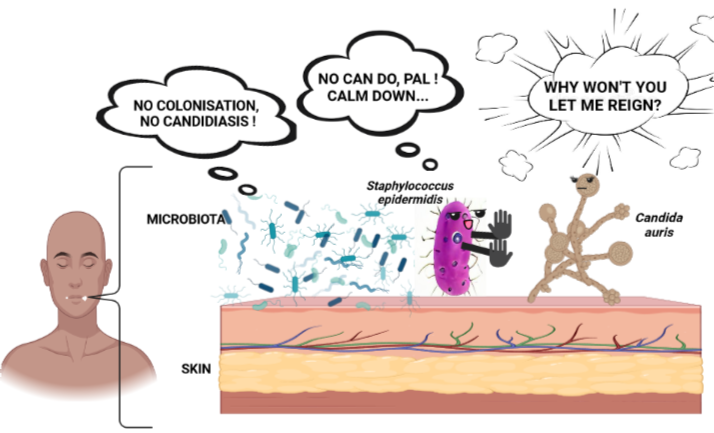
Gezien alles tot nu toe is het onnodig te benadrukken waarom we de invasie van deze schimmel moeten bestrijden om hem te onderwerpen aan zijn normale commensale (ongevaarlijke) staat.
Maar eerst moeten we de innerlijke werking van deze schimmel en zijn interacties begrijpen. En dit hebben Brooke Tharp en haar team gedaan (2023), waar zij de rol van de huidmicrobiota onderzochten die de kolonisatie van Candida auris mogelijk maakte. Zij benadrukken het belang van deze studie door te stellen: “Inzicht in microbiota, C. auris en gastheer interacties in de huid is belangrijk voor de ontwikkeling van op microbiomen gebaseerde therapeutische benaderingen om deze opkomende schimmel ziekteverwekker bij mensen te voorkomen en te behandelen.“
Normaal gesproken voorkomen commensalen dat pathogenen “gezellig” zijn door ofwel moleculen af te scheiden of huid immuunfactoren te stimuleren, interactief. Dit beïnvloedt het kolonisatieniveau en de mate van schade (pathogenese) van deze pathogenen op de menselijke huid.
De onderstaande tabel toont de verschillende soorten tussen de twee reeksen mensen (positief en negatief) in zowel schimmel- als bacteriesamenstelling. Hieruit blijkt dat C. auris zelfs de microbiële samenstelling van de gastheer en zijn reacties beïnvloedt!
| Microbial composition of patients | C.auris | |
| Positive (+) | Negative (-) | |
| Fungi | Candida species | Malassezia species |
| Bacteria | Proteus mirabilis, Pseudomonas aeruginosa, Klebsiella pneumoniae, Providencia stuartii, and Morganella morganii. | Staphylococcus hominis, Staphylococcus epidermidis, Staphylococcus caprae, Anaerococcus nagyae, Peptoniphilus tyrrelliae, Anaerococcus octavius, and Corynebacterium tuberculostearicum. |
Onder hen interacteren commensale microben via immuunfactoren om ziekteverwekkers te verdrijven. Effectieve communicatie is belangrijk om hen optimaal te laten functioneren.
Laten we eens kijken naar twee populaire huid immuunfactoren die C. auris remmen: interleukine 17 (IL-17) en cathelicidine of LL-37. IL-17 werkt samen met T helper 17 cellen om de kolonisatie van de huid door gist te controleren. LL-37 is een antimicrobiële peptide die wordt geproduceerd door menselijke keratinocyten (de buitenste epidermale cel van de huid). Het remt de schimmel door verschillende oppervlakte veranderingen teweeg te brengen, zijn celcyclus af te remmen en oxidatieve stress te induceren.
Wetenschappers gebruikten een homoloog (vergelijkbaar gen in een andere soort) van LL-37 dat cathelicidin antimicrobial peptide (CAMP) tot expressie brengt in muizen. Zij ontdekten dat het gebrek aan CAMP en zijn regulerende molecuul – hypoxia-inducible factor 1 alpha (HIF-1α) transcriptiefactor de huid van het knaagdier gevoelig maakte voor ziekteverwekkers. Bovendien komen deze twee moleculen in hoge mate tot expressie in de darm! Daar verhinderen zij de kolonisatie van C. auris door de darmmicrobiota weerstand te bieden tegen de gist. Terwijl studies over intestinale kolonisatie van C. auris vrij bekend zijn, zijn die over kolonisatie van de huid dat niet.
Impact en nieuwe portalen
Dit werk over huid kolonisatie is nog maar het begin en opent deuren voor een nieuw toepassingsgebied.
- De immuunrespons varieert tussen de Candida-soorten en door de interacties tussen de commensalen van de gastheer en elke pathogeen. Daarom is het belangrijk om de andere commensale spelers, variërend van Staphylococcus epidermidis (de representatieve commensale bacterie die in de studie werd gebruikt en waarover u hier en hier meer kunt weten), te identificeren en te begrijpen bij het verdedigen van de gezondheid van de huid. Immers, het bestuderen van een bepaalde soort-soort interactie kan niet worden geëxtrapoleerd om microbe-immuuncel interacties op/ in de huid samen te vatten.
- C. auris-positieve patiënten hebben veel minder huidcommensale microben dan hun mede-C. auris-negatieve patiënten. Uitbreiding van dit werk verkent de rol en mechanismen waarmee huidcommensale C. auris verdedigen tegen kolonisatie voor zijn snode doeleinden. De verworven kennis herstelt actief de commensale populatie in C. auris-positieve patiënten om de gistaanval op natuurlijke wijze tegen te gaan, en leidt tot de ontwikkeling van nieuwe antischimmelmiddelen.
- Verder kan door dit werk de latere nosocomiale (uit het ziekenhuis afkomstige) overdracht worden verstoord om sterfte door invasieve candidiasis (via C. auris) te voorkomen (herinner je je de statistieken aan het begin?).
- Momenteel wordt Staphylococcus hominis, die deel uitmaakt van de huidmicrobiota, al klinisch getest bij mensen voor de behandeling van huidinfecties en eczeem. Dit illustreert hoe het gebruik van commensale microben voor de behandeling van C. auris geen holle frase is, maar daadwerkelijk haalbaar.
Afbeelding 3: De afbeelding hierboven illustreert de groei van C. auris-biofilm, afgebeeld met rasterelektronenmicroscopie en afgebeeld op het oppervlak van de menselijke huid. Beeldbron: Emily F. Eix en Jeniel E. Nett (2022).
Al met al heeft extrapolatie van dit werk een groot potentieel om de gezondheidsbedreigende C. auris aan te pakken. We hopen ver vooruit te komen bij het aanpakken van dergelijke wereldwijde gezondheidsproblemen. Het Chinese spreekwoord: “Een reis van duizend mijl begint met een enkele stap” herinnert ons eraan dat dit werk werkelijk een van de stappen is om de kolonisatie van C. auris en de daaruit voortvloeiende ongebreidelde candidiasis onder controle te krijgen.
_______________
Original article: Tharp, B., Zheng, R., Bryak, G., Litvintseva, A. P., Hayden, M. K., Chowdhary, A., & Thangamani, S. (2023). Role of Microbiota in the Skin Colonisation of Candida auris. Msphere, e00623-22. DOI: https://doi.org/10.1128/msphere.00623-22
Feature image: Image source: Created by Tejaswini Petkar using craiyon.com and biorender.com.
Vertaald door: Liang Hobma